מעגל קרבס
מעגל קרבס (באנגלית: Krebs cycle) הוא מסלול מטבולי המשמש להפקת אנרגיה מתרכובות אורגניות ביצורים חיים.
למעגל קרבס, הקרוי על שם הביוכימאי היהודי-גרמני הנס אדולף קרבס, שלל שמות נוספים: מעגל חומצת הלימון, מעגל החומצה הציטרית, מעגל החומצות הטריקרבוקסיליות (או בקיצור: מעגל TCA) ומעגל קרבס-סנט-גיירגי.
חשיבות המסלול
ביצורים אווירניים מהווה מעגל קרבס את השלב השני מתוך שלושה בתהליך הנשימה התאית. לפני המעגל מתרחשת הגליקוליזה; התוצר שלה, פירובט, הופך לאצטיל קואנזים A, אשר מהווה את תחילתו של מעגל קרבס. התוצרים של המעגל הם 2 מולקולות ATP וכן שני קואנזימים מחוזרים (כלומר - נושאי אלקטרונים עודפים; מקורם של האלקטרונים באצטיל קואנזים A אשר מפורק בַמעגל); שני אלו - NADH ו-FADH2 - עוברים לשלב השלישי של הנשימה, הזרחון החמצוני, שם הם תורמים את האלקטרונים שלהם לחמצן. מעבר האלקטרונים מהמזון (ראשיתו של תהליך הנשימה התאית) אל החמצן (סופו של תהליך הנשימה התאית) מלווה בפליטת אנרגיה, אותה מסוגל התא לנצל בשלב מאוחר יותר.
מעגל קרבס מתרחש במטריקס של המיטוכונדריה ביצורים אוקריוטיים ובציטופלזמה ביצורים פרוקריוטיים (חיידקים).
הכנה למעגל קרבס: מפירובט לאצטיל קואנזים A
החומר ההתחלתי שנכנס למעגל קרבס הוא אצטיל קואנזים A; החומר הסופי בתהליך הגליקוליזה, לעומת זאת, הוא פירובט. לפני מעגל קרבס מתרחשת לפיכך המרה של השני לראשון.
קואנזים A, מולקולה ארוכה הנגזרת מ-ATP ומוויטמין B5, משמש בסך הכול כנשא של קבוצת האצטיל (CH3C=O), והוא אינו משתתף בתגובה כלשהי. האצטיל לבדו אינו נוטה להגיב עם תרכובות אחרות, והיותו מחובר לקואנזים A גורמת ל"הפעלתו". האתר הפעיל של קואנזים A נמצא בקצה המולקולה; זוהי קבוצת תיול (סולפהידריל, אטום גופרית הקשור לאטום מימן: SH). קבוצת התיול נוטה לאבד את אטום המימן ולהתרכב עם אצטיל; תכונה זו משמשת לא רק במעגל קרבס, אלא גם בעשרות מסלולים מטבוליים אחרים בתא.
הקבוצה שאכן מגיבה במעגל קרבס היא לפיכך אצטיל. פירובט מכיל שלושה אטומי פחמן, ואילו אצטיל - שני אטומי פחמן. בצעד המקדים למעגל קרבס נפטר הפירובט מאטום פחמן אחד ומשני אטומי חמצן; התוצר הוא אצטיל ופחמן דו-חמצני. כאן מתרחשת, אם כן, הפליטה הראשונה של פחמן דו-חמצני (בבעלי חיים מפותחים: אל מחזור הדם ומשם אל הריאות והחוצה אל האוויר). שתי מולקולות נוספות של פחמן דו-חמצני, שמקורן הוא האצטיל, נפלטות במהלך מעגל קרבס. בנוסף לפחמן הדו-חמצני נפלטים גם שני אלקטרונים ופרוטון אחד, דהיינו - יון הידריד (-H). את היון קולט נשא האלקטרונים NAD ומעביר אותו לשרשרת הנשימה, בדומה לשאר האלקטרונים הנאספים על ידי NAD בגליקוליזה ובמעגל קרבס עצמו.
התגובה שבמהלכה נפלט פחמן דו-חמצני מפירובט מכונה דקרבוקסילציה (שכן ה-COO שנפלט מהווה קבוצת קרבוקסילט). את התגובה מזרז האנזים PDH, פירובט דהידרוגנאז (Pyruvate dehydrogenase). זהו מערך סבוך ומשוכלל של שלושה אנזימים וחמישה קואנזימים.
שלבי התהליך
המעגל מורכב משרשרת של שמונה תגובות כימיות; בתגובה הראשונה משתתף חומר (המכיל 4 אטומי פחמן) הנקרא אוקסלואצטט (Oxaloacetate); חומר זה נוצר גם בתגובה האחרונה בשרשרת, ולפיכך מדובר ב"מעגל": אוקסלואצטט מגיב בתחילת המעגל עם אצטיל קואנזים A, וגורם בכך להתנעת התהליך; מולקולת האוקסלואצטט הנוצרת בסוף התהליך יכולה להגיב עם עוד מולקולת אצטיל קואנזים A ולהתניע מעגל חדש; לפיכך, מולקולת אוקסלואצטט אחת יכולה להגיב עם מספר בלתי מוגבל של מולקולות אצטיל קואנזים A.
פירוט שלבי מעגל קרבס
- אוקסאלואצטט מתחבר לאצטיל קואנזים A ויוצר ציטרט (Citrate), מולקולה בת שישה פחמנים. שלב זה מתרחש בעזרת האנזים citrate synthase. זהו שלב חד כיווני.
- ציטרט עובר שינוי איזומרי והופך לאיזוציטרט (Isocitrate). שלב זה מתרחש בעזרת האנזים aconitase.
- איזוציטרט מאבד פחמן דו-חמצני והופך לאלפא-קטוגלוטרט (α-Ketoglutarate), מולקולה בת חמישה פחמנים. שלב זה מתרחש בעזרת האנזים isocitrate dehydrogenase.
- אלפא-קטוגלוטרט מאבד פחמן דו-חמצני, מתחבר לקואנזים A ויוצר סוקציניל (Succinyl) קואנזים A. שלב זה מתרחש בעזרת האנזים α-Ketoglutarate dehydrogenase. כעת נותרו 4 פחמנים, אם כן ניתן לראות כי שני אטומי פחמן נכנסים למעגל כיחידות acetyl ושני אטומי פחמן עוזבים אותו בצורת פחמן דו-חמצני.
- סוקציניל קואנזים A מאבד קואנזים A והופך לסוקצינט (Succinate). שלב זה מתרחש בעזרת האנזים succinyl coA synthase בתהליך היוצר מולקולת GTP.
- סוקצינט הופך לפומרט (Fumarate). שלב זה מתרחש בעזרת האנזים Succinate dehydrogenase.
- פומרט הופך למלט (Malate). שלב זה מתרחש בעזרת האנזים fumarase.
- מלט הופך לאוקסאלואצטט. שלב זה מתרחש בעזרת האנזים malate dehydrogenase.
ניתן לראות כי איבוד של פחמן דו-חמצני מתרחש פעמיים לאורך המעגל. זוהי מהותו ותפקידו העיקרי של המעגל: אטומי הפחמן, שמקורם בגלוקוז, בחלבונים ובחומצות השומן שאנו צורכים במזון, מתחמצנים באופן מלא והופכים לפחמן דו-חמצני, אשר בבעלי חיים נפלט מהתא אל מחזור הדם ולאחר מכן אל הסביבה בתהליך הנשימה. זהו מקורו של הפחמן הדו-חמצני שאנו נושפים מריאותינו. כשהמזון מתחמצן לפחמן דו-חמצני הוא מאבד אלקטרונים, אשר מועברים ממעגל קרבס אל השלב הסופי של הנשימה התאית - הזרחון החמצוני - שם הם יימסרו באופן סופי למולקולות חמצן. מעגל קרבס הוא, אם כן, התחנה הסופית של תהליך פירוק המזון שאנו צורכים (שכן בזרחון החמצוני לא נעשה כל פירוק שהוא, והדבר גם אינו אפשרי - המזון כולו חומצן במעגל קרבס לפחמן דו-חמצני ונפלט אל הסביבה).
ניתן גם לראות (בעזרת התרשים) את מקור שמותיו של המעגל: "מעגל חומצת הלימון" קרוי על שם תוצר הביניים הראשון - ציטרט (היון של חומצה ציטרית, חומצת לימון); "מעגל החומצות הטריקרבוקסיליות" כיוון שציטרט, איזוציטרט ואלפא-קטוגלוטרט הם יונים של חומצות קרבוקסיליות משולשות, המכילות שלוש קבוצות קרבוקסיל (COOH).
שלב I - ציטראט
 ערך מורחב – ציטראט סינתאז
ערך מורחב – ציטראט סינתאז
הריאקציה הראשונה במעגל קרבס היא תגובת דחיסה אלדולית של אצטיל קואנזים A עם אוקסלואצטט ליצירת ציטראט, המקוטלזת על ידי ציטראט סינתאז.
משוואת הריקאציה:
בריאקציה, פחמן המתיל מקבוצת האצטיל של האצטיל קואנזים A, מצטרף לקבוצת הקרבוניל (C-2) של האוקסלואצטט. בשלב זה נוצר תוצר ביניים באתר הפעיל של האנזים - ציטרואיל קואנזים A, אשר עובר במהירות הידרוליזה ומשחרר מולקולות ציטראט וקואנזים A חופשיות.
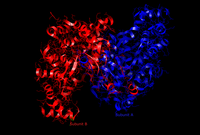
|

|
| האתר הפעיל של ציטראט סינתאז בצורתו הפתוחה (מימין; האנזים לבדו) והסגורה (משמאל; בעת קישור לאוקסלואצטט). | |
האנזים ציטראט סינתאז המצוי אצל בעלי חיים, צמחים, פטריות, ארכיאה וחיידקים גראם-חיוביים מורכב מ-2 דומיינים, קטן וגדול, וביניהם נמצא האתר הפעיל של האנזים, ובו 2 אתרי קשירה - האחד לציטראט או לאוקסלואצטט והשני לקואנזים A. האתר הפעיל מורכב מ-3 שיירי חומצות אמינו ("שלשה קטליטית") החיוניים לפעילותו - 2 שיירי היסטידין ושייר אספרטט אחד (His274, His320 ו-Asp375), להם סלקטיביות גבוהה לסובסטרטים של הריאקציה. צורתו המרחבית של האנזים משתנה מפתוח לסגור בעת הקישור עם הסובסטרטים שלו (כמו אוקסלואצטט). אצל אצות וחיידקים גראם-שליליים, האנזים מורכב מ-4 עד 6 דומיינים זהים והוא תלוי NADH. ציטראט סינתאז הוא האנזים היחיד במעגל קרבס אשר יכול לקטלז יצירת קשר פחמן-פחמן.[1]
ההידרוליזה של הקשר התיאו-אסטרי עתיר האנרגיה הופכת את הריאקציה לאקסרגונית מאוד. האנרגיה החופשית הסטנדרטית של גיבס בריאקציה זו היא שלילית מאוד, ומשמעות הדבר ששלב זה חד כיווני; דבר זה חיוני מאוד לפעילותו של מעגל קרבס, מאחר שריכוז האוקסלואצטט הוא נמוך מאוד במצב נורמלי.[2]
מולקולת הקואנזים A ששוחררה בריאקציה ממוחזרת, ותשתתף בדה-קרבוקסילציה חמצונית של מולקולת פירובט נוספת שתיכנס לקומפלקס PDH.[2]
שלב II - איזוציטראט
השלב השני של מעגל קרבס הוא יצירת איזוציטראט באמצעות תגובת איזומריזציה, דרך תוצר הביניים ציס-אקוניטאט (משתייכת למשפחת התלת קרבוקסיליות). התגובה מקוטלזת על ידי האנזים אקוניטאז הידרטאז (בקיצור: אקוניטאז).
אקוניטאז מפעיל מנגנון דהידרציה-הידרציה, כאשר באתר הפעיל מעורב בקטליזה צבר אטומי ברזל-גפרית [4Fe-4S][3]; השיירים הקטליטיים המעורבים באתר הפעיל הם His101 ו-Ser642, ומלבדם קיימים לפחות 21 שיירי חומצות אמינו נוספים המעורבים בזיהוי הסובסטרט, ייצוב מבנה ה-[4Fe-4S] ועוד.[4]
בשלב הראשון של הריאקציה His101 פועל כחומצה (מוסר פרוטון) ועושה פרוטונוציה על קבוצת ההידרוקסיל שעל פחמן מס' 3 של הציטראט, ומאפשר לו להשתחרר כמולקולת מים ("דה-הידרציה"). בו זמנית, Ser642 מקבל את הפרוטון הקשור לפחמן מס' 2, כך שנוצר קשר כפול בין פחמנים מס' 2-3, ומתקבל תוצר הביניים ציס-אקוניטאט. בנקודה זו, המולקולה עושה "פליפ" ומסתובבת ב-180° באופן שפחמן מס' ופחמן מס' 3 מחליפים את העמדות שלהם; נהוג לומר שה"פליפ" הזה משנה את המולקולה מ"מצב ציטראטי" ל"מצב איזוציטראטי".[5]
בשלב האחרון יש שימוש בתגובת הידרציה, כך שקבוצת ההידרוקסיל והמימן יקשרו מחדש למולקולה אך הפעם בסטריאוכימיה הפוכה; במולקולת הציטראט הייתה קבוצת ההידרוקסיל קשורה לפחמן מס' 3 והמימן לפחמן מס' 2, ובמולקולת האיזוציטראט - ההידרוקסיל קשור לפחמן מס' 2 ואילו המימן לפחמן מס' 3. על מנת שפעולה זו תתרחש, השיירים הקטליטיים משנים את פעילותם: His101 משמש עתה כבסיס ומקבל פרוטון ממולקולת מים, כך שנותר הידרוקסיל המשמש כנוקליאופיל ותוקף את פחמן מס' 2. שייר ה-Ser642 עובר דה-פרוטונוציה על ידי הקשר הכפול של ציס-אקונטיאט כדי להשלים את ההידרציה, כך שיצצור איזוציטראט.
שלב III - אלפא-קטוגלטראט
בשלב השלישי מתרחשת דה קרבוקסילציה חמצונית של איזוציטראט, וקבלת התוצר אלפא קטוגלוטראט דרך תוצר הביניים אוקסלוסוקצינאט. התגובה מקוטלזת על ידי האנזים איזוציטראט דהידרוגנאז (IDH), ובמהלך התגובה משתחררת מולקולת הפחמן דו-חמצני הראשונה במעגל.
האנזים איזוציטראט דהידרוגנאז מורכב מ-3 תתי יחידות ודורש לפעילותו יון מגנזיום דו ערכי (Mg2+) או יון מנגן דו ערכי (Mn2+) באתר הפעיל. בבני אדם, האנזים קיים ב-3 איזופורמים: IDH3 מקטלז את ריאקציית השלב השלישי במעגל קרבס תוך כדי חיזור +NAD ל-NADH, ואילו IDH1 ו-IDH2 מקטלזים את אותה התגובה אך לא בקונטקסט של מעגל קרבס, ופועלים במיטוכונדריה, בפראוקסיזום ובציטוזול.
שלבי הריאקציה (דיאגרמה מצד שמאל):
- חמצון האיזוציטראט (כוהל שניוני) לאוקסלוסוקצינאט (קטון): קבוצת האלכוהול שעל פחמן אלפא (C#2) עוברת דה-פרוטונוציה, כך שנוצר במקומו קטון (הכוללת כמובן קבוצת קרבוניל, C=O) ונפלט הידריד; הקופקטור +NAD משמש כנשא אלקטרונים וקולט את ההידריד, ומחוזר ל-NADH.
- דה-קרקבוקסילציה של אוקסלוסוקצינאט: החמצן שקשור לקבוצת הקרבוניל מותקף על ידי שייר טירוזין ועובר דה-פרוטונציה, וגורם לשחרור פחמן דו-חמצני מפחמן בטא (C#3) כקבוצה עוזבת. האלקטרונים נעים לעבר פחמן אלפא, יוצרים קשר כפול בין פחמנים אלפא ובטא ומפרקים את הקשר הכפול של הקרבוניל; משם נעים לאטום החמצן של קבוצת הקטון (החמצן הקשור לפחמן אלפא) וטוענים אותו מטען שלילי. זוג האלקטרונים הבלתי קושרים שעל פחמן אלפא אוסף מימן משייר ליזין סמוך. בשלב זה המולקולה השתנתה מצורת הקטו של האקוסלוסוקצינאט לצורת האנול, ויצרה יון אנולט. בשתי הצורות, הן בצורת הקטו (לפני עזיבת הפחמן הדו-חמצני) והן בצורת האנול, יון המגנזיום/מנגן בעל המטען החיובי הדו ערכי יוצר אינטרקציה עם אטומי החמצן הטעונים מטען שלילי ומייצב את המולקולה.
- שחלוף של צורת האנול ליצירת אלפא קטוגלוטראט: שייר ליזין מתקיף את אטום החמצן הקשור לפחמן אלפא וגורם לדה-פרוטונציה שלו, כך שזוג האלקטרונים הבלתי קושרים שלו יוצר שוב קשר כפול, ושובר את הקשר הכפול שבין פחמנים אלפא לבטא. זוג האלקטרונים הבלתי קושרים שהרכיב את הקשר הזה תוקף שייר ליזין, וגורם לקשירת אטום מימן לפחמן בטא.
שלב IV - סוקציניל קואנזים A
בשלב הרביעי מתרחשת דה-קרבוקסילציה חמצונית נוספת, הפעם של תוצר השלב הקודם - אלפא קטוגלוטראט, ויצירת סוקציניל קואנזים A. הריאקציה מקוטלזת על ידי האנזים אלפא קטוגלוטראט דהידרוגנאז קומפלקס (OGDC).
חשיבות קלינית
הרווח האנרגטי
במהלכו של מעגל קרבס נוצרת מולקולה אחת בלבד של הנוקלאוטיד ATP (לעיתים נוצר GTP, אשר מומר במהרה על ידי אנזים ל-ATP), "מטבע האנרגיה" של כל היצורים החיים. על כל מולקולת גלוקוז שאנו צורכים במזון, אם כן, מתקבלות שתי מולקולות ATP במעגל קרבס (כיוון שגלוקוז מתפרק בגליקוליזה לשתי מולקולות פירובט, וכל אחת מהן מתניעה סיבוב נפרד של מעגל קרבס).
בגליקוליזה מתקבלות גם כן שתי מולקולות ATP; לעומת זאת, בשלב הבא של הנשימה, הזרחון החמצוני, מתקבלות 30 - 36 מולקולות ATP. ברור, אם כן, שהזרחון החמצוני הוא השלב בו מופקת רוב האנרגיה; הגליקוליזה ומעגל קרבס הם שלבים מקדימים בלבד.
מעגל קרבס כצומת מטבולי
בנוסף לתפקידו העיקרי של מעגל קרבס - הפקת אנרגיה - משמש המעגל גם כצומת מטבולי בעל חשיבות עליונה. כל תוצרי הביניים של המעגל (ראו לעיל) משמשים לסנתוז ובניית חומרים שונים בתא (אנבוליזם). בנוסף, תרכובות רבות שאנו צורכים במזון, ואשר מהן לא מופקת אנרגיה באופן ישיר (נוקלאוטידים, חומצות אמינו, חומצות שומן - מתפרקים (עוברים קטבוליזם) בתא ותוצריהם מומרים לתוצרי הביניים של מעגל קרבס, כך שתרכובות אלו יכולות להיכנס ישירות למעגל ולהזין אותו.
ביבליוגרפיה
- Cox MM, Nelson DL (2005). Lehninger Principles of Biochemistry (4th ed.). New York: W.H. Freeman. מסת"ב 978-0-7167-4339-2
- Lauble, H., Kennedy, M. C., Beinert, H., & Stout, C. D. (1992). Crystal structures of aconitase with isocitrate and nitroisocitrate bound. Biochemistry, 31(10), 2735-2748}
- Lloyd, S. J., Lauble, H., Prasad, G. S., & Stout, C. D. (1999). The mechanism of aconitase: 1.8 Å resolution crystal structure of the S642A: citrate complex. Protein Science, 8(12), 2655-2662.
- Remington, S. James (1992), "Structure and Mechanism of Citrate Synthase", University of Oregon. In Stadtman, Earl R & Chock P. Boon (Eds.), "Current Topics in Cellular Regulation, Volume 33: From Metabolite, to Metabolism, to Metabolon", (p. 209-229), Academic Press, Inc., San Diego, California. מסת"ב 9781483217321
- Wiegand G, Remington SJ (1986). "Citrate synthase: structure, control, and mechanism". Annual Review of Biophysics and Biophysical Chemistry. 15: 97–117. PMID: 3013232.
קישורים חיצוניים
הערות שוליים
- ^ Wiegand G, Remington SJ (1986), p. 97-98
- ^ 2.0 2.1 Cox & Nelson (2005), pp. 608−9.
- ^ באופן כללי, האנזים מורכב מ-4 דומיינים וקיים ב-2 צורות: פעיל ולא פעיל. בצורה הלא פעילה, שלושת הדומיינים הראשונים מעורבים באינטרקציות הדוקות עם צבר ה-[3Fe-4S] בעל מבנה הקוביה שבאתר הפעיל בעוד שהדומיין הרביעי קשור באינטרקציות חלשות יותר באמצעות פפטיד מוארך; ובצורה הפעילה, האנזים קושר אטום ברזל נוסף ויוצר צבר [4Fe-4S]. ראו Lauble et al. (1992), p. 2736
- ^ Lauble et al. (1992), p. 2735
- ^ Lloyd et al. (1999), p. 2655
| מטבוליזם | ||
|---|---|---|
| נשימה תאית | גליקוליזה • מעגל קרבס • זרחון חמצוני | |
| מסלולים נוספים | גלוקונאוגנזה • גליקוגנזה • גליקוגנוליזה • מסלול הפנטוז פוספט • מעגל קורי • מעגל האוריאה • חמצון בטא • תסיסה מעגל קלווין • מעגל הגליוקסילט • פוטוסינתזה • ניטריפיקציה | |
| תרכובות עיקריות | גלוקוז • פירובט • NAD • כלורופיל | |
| מגוון מטבולי | אורגניזם אווירני • אורגניזם אל-אווירני • הטרוטרוף • אוטוטרוף | |




