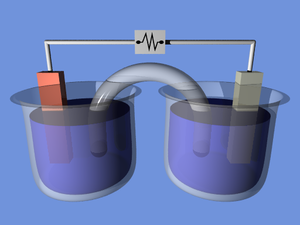
תא אלקטרוכימי
תא אלקטרוכימי הוא התקן כימי שמסוגל לייצר חשמל באמצעות תגובות כימיות או לנצל חשמל לצורך ביצוע תגובות כימיות. תא שמייצר חשמל קרוי תא גלווני ותא שמבצע אלקטרוליזה קרוי תא אלקטרוליטי.
בתא גלווני הפרש של פוטנציאל כימי בין שני חלקי התא אחראי ליצירת המתח החשמלי (כוח אלקטרו מניע) בין שתי האלקטרודות הקבועות בכל אחד מחצאי התא. בכל אחד מחצאי התא מתרחשת מחצית אחת של התגובה הכימית הכוללת בתא. זוהי תגובה מסוג חמצון-חיזור – בחצי הנקרא אנודה מתרחש חמצון, ובחצי המכונה קתודה מתרחש חיזור. תגובות חמצון-חיזור כרוכות בהעברת אלקטרונים מהמחזר למחמצן: תא גלווני מפריד בין השניים, והאלקטרונים זורמים לכן מהאנודה אל הקתודה, ויוצרים זרם חשמלי.
מבנה התא
אלקטרודות
בצורתו הבסיסית ביותר, יכיל כל חצי תא גלווני פיסת מתכת, המכונה אלקטרודה, המתכת טבולה בתוך תמיסה מימית של יונים חיוביים (קטיונים) של אותה המתכת. לעיתים משתמשים בשם "אלקטרודה" לתיאור חצי התא כולו. בכל אחד מחצאי התא, המתכת והיונים של המתכת יהיו שונים. באנודה, בה מתרחש חמצון, תתפרק אלקטרודת המתכת בהדרגה אל תוך התמיסה, כשאטומי המתכת הנייטרליים ימסרו את האלקטרונים שלהם ויצאו אל התמיסה כיונים טעונים חיובית. בקתודה, בה מתרחש חיזור, תצופה האלקטרודה באטומי מתכת שיצאו מהתמיסה – כלומר בקטיונים שיקבלו, על גבי האלקטרודה, אלקטרונים המגיעים מחצי תא החמצון. כדי לאפשר את זרימת האלקטרונים מהאנודה לקתודה, מחוברות שתי האלקטרודות בתיל מוליך. באופן כללי, זו התגובה המתרחשת בחצאי התא הפשוטים ביותר – בקתודה משמאל לימין, ובאנודה מימין לשמאל:
(1) Mn+ + ne- ↔ Ms
M מסמן מתכת, n את מטען היון המתכתי, האות e מסמנת אלקטרון ו-s מציין מצב צבירה מוצק.
בהיעדר חיבור מוליך בין האלקטרודות, תתרחש בכל חצי תא תגובת שיווי המשקל (1), בשיעור זעיר שלא ישפיע על ריכוז יוני המתכת בתמיסה ושקשה למדוד אותו.
גשר מלח
תוספת הקטיונים לתמיסה באנודה, וגריעת הקטיונים מהתמיסה בקתודה, יביאו – תוך שניות מספר מחיבור האלקטרודות זו לזו – לעצירת הזרם. זאת משום שבכל אחת מהתמיסות ייווצרו מטען חשמלי ושדה חשמלי שכוחם על הקטיונים גדול מהפוטנציאל החשמלי בתא. כדי לפתור בעיה זו, ולאפשר את איזון המטענים בשתי התמיסות, מחברים אותן בגשר מלח – מתקן המחזיק מלח מסיס (KNO3 הוא בחירה שגרתית) ומשחרר אניונים לאנודה וקטיונים לקתודה (לא ייתכן מצב שבתמיסה המטען הכולל של היונים החיוביים יהיה גדול יותר מהשליליים או להפך). לרוב, משמשת צינורית זכוכית שצורתה U וקצותיה נקבוביים כגשר מלח: היונים עוברים דרך הנקבים, ללא זליגה חופשית של התמיסה. נייר סינון ספוג בתמיסת המלח, או תמיסה ג'לית (מבוססת אגר) של המלח יבצעו את אותה פעולה. אפשרות מסובכת יותר היא הפרדת שני חצאי התא במחיצה נקבובית.
מבנים אחרים
כאשר אין בין מרכיבי חצי התא מתכת, ישמש כאלקטרודה מוט עשוי מתכת אדישה (אינרטית) כגון פלטינה. במקרים בהם המומסים בתא הם מחזרים חזקים מיוני פלטינה (שהפוטנציאל שלהם 1.2V+), עלולה הפלטינה להתחמצן, ואז מחליפים אותה במוט גרפיט, טבול בתוך תמיסת חצי התא. מערכות מסוימות מכילות גזים, המבעבעים לתוך תמיסת חצי התא סביב האלקטרודה.
תא תקני
מדידת פוטנציאלים מוחלטים, להבדיל ממדידת ההפרש ביניהם (המתח) היא משימה קשה. כדי לאפשר השוואה בין פוטנציאלי חצאי תא שונים, נעשה תיקנון (סטנדרטיזציה) של חצאי התא השונים: תא תקני הוא תא שאקטיביות המומסים בו היא 1 (בקירוב 1M), לחץ הגזים בו 1bar (בקירוב אטמוספירה אחת), והטמפרטורה שלו היא 25 מעלות צלזיוס (טמפרטורת החדר).
תא מימן
כבתחומי ידע אחרים, נקבעה גם כאן נקודת ייחוס – חצי תא שהפוטנציאל שלו יחשב 0, ופוטנציאלי חצאי התא האחרים ימדדו ביחס אליו. זוהי אלקטרודת המימן התקנית (באנגלית SHE, Standard Hydrogen Electrode): מוט פלטינה שרוי בתמיסת יוני מימן, +H, בריכוז 1M בקירוב, וגז מימן מבעבע סביבו בלחץ של 1bar (התגובה המתרחשת בתא זה היא: קטיונים של מימן מקבלים אלקטרון ונהפכים לגז מימן). פוטנציאל תקני של חצי תא הוא לפיכך מתח התא המתקבל בחיבור חצי התא התקני לחצי תא מימן תקני, כפי שמוסבר להלן.
פוטנציאלים תקניים
הפוטנציאלים התקניים של חצאי התא הוגדרו כפוטנציאל של חצאי התא לעבור חיזור (לקבל אלקטרונים ואי לכך להיות חצי תא מחמצן). לדוגמה, פוטנציאל חצי התא המכיל את המתכת M עבורה נוסחה תגובה (1), הוא הפוטנציאל של תא זה לעבור את התגובה (1) משמאל לימין. הפוטנציאל התקני של התא, המסומן ב- Eo, מוגדר לפיכך:
E0(תא)=E0(קתודה)-E0(אנודה)
כיוון זרימת האלקטרונים
אם מתח התא המתקבל חיובי (E0>0), יזרמו האלקטרונים כמצופה מהאנודה לקתודה. אם מתח התא המתקבל שלילי (E0<0), הרי שהאלקטרודות הוגדרו במהופך: בזו שהוגדרה אנודה יתרחש חיזור, ובחברתה חמצון. כלומר, חצי התא שהפוטנציאל שלו לעבור חיזור גדול יותר, יהיה הקתודה בה מתרחש החיזור, והאלקטרונים יזרמו אליו מהאנודה, בעלת פוטנציאל החיזור הנמוך יותר, בה יתרחש החמצון.
דוגמה לתא אלקטרוכימי
ניקח חצי תא שבו ישנה אלקטרודת ברזל הטבולה בתמיסה המכילה יוני ברזל, וחצי תא שבו ישנה אלקטרודת מגנזיום הטבולה בתמיסה המכילה יוני מגנזיום. בשני חצאי התא החשמלי מתרחשת תגובת שיווי משקל שבה המתכת המוצקה הופכת ליונים טעונים שלה ולהפך. כעת נחבר לתא נורה (או כל מכשיר חשמלי אחר) כאשר קצוות החוטים שיוצאים ממנה נוגעים באלקטרודות. נחבר לתא גם את גשר המלח הטבול בתמיסה מימית המכילה יונים שאינם מצויים באף אחד מחצאי התאים. הנורה תידלק ואט אט תיחלש עוצמת ההארה שלה.
הסבר התופעה
פוטנציאל החיזור, היכולת לקבל אלקטרונים, של הברזל גדול מזה של המגנזיום, ולכן תתחיל תנועת אלקטרונים מחצי תא המגנזיום לחצי תא הברזל. כתוצאה מכך המגנזיום המוצק יתפרק לקטיונים טעונים חיובית ואלקטרונים, ואילו יוני הברזל יקבלו אותם ויהפכו לברזל מוצק. לפיכך, בחצי תא הברזל יקטן ריכוז יוני הברזל (ירידה בריכוז הקטיונים) ואילו בחצי תא המגנזיום יגדל מספר יוני המגנזיום (ויקטן ריכוז האניונים). לכן, קטיונים מגשר המלח יזרמו לעבר תא הברזל ואניונים מגשר המלח יזרמו לעבר תא המגנזיום (קטיונים לקתודה ואניונים לאנודה).
מהלך הזרם הוא כדלקמן: האלקטרונים שנוצרו כתוצאה מפירוק אלקטרודת המגנזיום נעים על המוליך המתכתי שמחבר בין שני חצאי התאים לעבר הנורה ומשם לאלקטרודת הברזל. הברזל המוצק נטען באלקטרונים העוברים ליונים בעלי המטען החיובי של הברזל. כך הם נהפכים לברזל מוצק שמצפה את אלקטרודת הברזל ומוסיף למסתה. קטיונים עוברים מגשר המלח לחצי תא הברזל ואניונים לחצי תא המגנזיום. הולכת הזרם מתאפשרת, אם כן, הודות לקיומו של גשר המלח, המספק יונים ניידים.
תא אלקטרוכימי תקני הוא תא שכל אחד מחצאי התאים שלו תקני. הכוונה שהטמפרטורה של מערכת הניסוי תהיה טמפרטורת החדר, 25 מעלות צלזיוס, שכל הגזים המעורבים בתגובה יהיו בלחץ של אטמוספירה אחת ושריכוז היונים בכל אחת מהתמיסות הוא מולר אחד- 1M (מול יונים לליטר מים). עם ההתקדמות עד לקבלת שיווי משקל יירד מתח התא עד שהנורה תכבה. במצב זה נוצר שוויון פוטנציאלים שנדון במסגרת האלקטרוכימיה. פוטנציאל החיזור של חצי תא ברזל תקני ((Fe(s)|Fe2+(aq) הוא 0.45- וולט ואילו פוטנציאל החיזור של חצי תא מגנזיום הוא 2.37-. אם נחסר את הערך הגבוה מן הערך הנמוך נקבל את המתח הראשוני של התא: 1.92 וולט.
הסיבה שלחומרים מסוימים יש פוטנציאל חיזור חיובי ולאחרים שלילי היא יחסית. הקהילה המדעית הגדירה את חצי תא המימן (שבו יוני הידרוניום הופכים לגז מימן ולמים כנקודת ייחוס לשאר המדידות), וקבעה את הפוטנציאל שלו ל-0. לכן:
אם נחבר חצי תא ברזל ((Fe3+(aq)|Fe2+(aq) (ישנם שני סוגים של חצאי תא ברזל. בחצי תא ברזל זה, קטיון שחסרים לו שלושה אלקטרונים מקבל אלטרון אחד וכך קטן מטענו החיובי. בחצי תא זה לא משתתפת בתגובה מתכת ברזל במצב מוצק (ראו טבלת פוטנציאלי חיזור בהמשך)) לחצי תא מימן מתח התא יהיה 0.77 וולט כאשר האלקטרונים נעים לכיוון חצי תא הברזל, כלומר חצי תא הברזל הוא חצי התא הקטודי.
אם נחבר חצי תא מימן לחצי תא מגנזיום מתח התא יהיה 2.37 וולט כאשר האלקטרונים נעים לכיוון חצי תא המימן, כלומר הוא יהווה את חצי התא האנודי, ומכאן הסימן השלילי.
באופן כללי, לחצאי תאים של אל-מתכות פוטנציאל חיזור גבוה יותר מאלה של המתכות (האל מתכות הם מחמצנים טובים יותר, לעומת המתכות שנוטות לוותר על האקטרונים שלהם ולעבור תהליך חמצון).
מידע נוסף
כמו בכל תגובה המתבססת על שיווי משקל כימי, גם לתא האלטרוכימי ניתן להפריע ולחזות את התוצאות. לפי עקרון לה שטליה, כל פעולה שנבצע תגרום לתגובה הפוכה של המערכת. את פוטנציאל החיזור של כל חצי תא יש לראות כתוצר. אם נוסיף למשל לחצי תא הברזל מלח המכיל ברזל, אז הגדלנו את ריכוז המגיב (יוני הברזל) ולכן המערכת תפעל להורדתו. כך יעלה הפוטנציאל של חצי תא הברזל ונוכל לקבל מתח גדול יותר. באותו אופן, אם נמהול את התמיסה של חצי תא המגנזיום, אז המערכת תפעל כדי להעלות את הריכוז וכך פוטנציאל החיזור של חצי תא המגנזיום יקטן. שוב, נוכל לקבל זרם התחלתי גבוה יותר כעת שאחד מחצאי התאים אינו תקני.
הוספה או החלפה של אלקטרודה כלשהי באלקטרודה אחרת קטנה או גדולה יותר, לא יצור שינוי במערכת. כמות האטומים המוצקים גדולה בהרבה מכמות היונים בתמיסה בכל חצי תא, ולכן שינוי במסת האלקטרודה, גדול ככל שיהיה לא יגרור תגובה. (הדבר דומה ללקיחת או לנתינת שקל למיליונר).
המתח המקסימלי בין חצאי תא תקניים יתקבל בין חצי תא תקני של פלואור (פלואור הוא המחמצן החזק ביותר) לחצי תא תקני של ליתיום (ליתיום הוא המחמצן החלש ביותר, הוא החזק ביותר מבחינת חיזור). חצי תא הפלואור יהיה קתודה וחצי תא הליתיום יהיה אנודה. המתח ההתחלתי בתא זה יהיה 5.9 וולט.
קישורים חיצוניים
| מיזמי קרן ויקימדיה |
|---|
- סטיבן ס. הול, "התא החשמלי - הכול התחיל עם הצפרדע", מתוך "מגלים וממציאים" ספרית מעריב 1991 ו"כמעט 2000 - כתב העת למדע וטכנולוגיה" הוצאת האוניברסיטה העברית בירושלים - המרכז להוראת המדעים; באתר סנונית
- ארז גרטי, תא אלקטרוכימי, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 28 ביוני 2011
- תכנון מערכות אלקטרוכימיות לצבירה ולהמרה של אנרגיה לנוכח האתגרים שבהנעה החשמלית ובשימוש באנרגיה מתחדשת - כתב העת אקולוגיה וסביבה אוקטובר 2015