חמצן דו-פלואורי
 | |
| מולקולת חמצן דו-פלואורי | |
 | |
| שם סיסטמטי | Oxygen difluoride |
|---|---|
| שמות נוספים | oxygen fluoride |
| מסה מולרית | 53.996 גרם/מול |
| מראה | גז שקוף, הנוזל צהוב בהיר |
| מספר CAS | 7783-41-7 |
| מצב צבירה | גז |
| מסיסות | מתפרק במים |
| טמפרטורת היתוך |
-223.8 °C 49.35 K |
| טמפרטורת רתיחה |
-144.75 °C 128.4 K |
| NFPA 704 | |
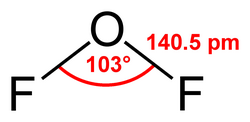
חמצן דו פלואורי הוא תרכובת אי אורגנית המורכבת מחמצן ופלואור שנוסחתה OF2. כחזוי ממודל VSEPR המולקולה מכופפת בדומה למולקולת המים. החומר הוא מחמצן חזק.
הכנה
חמצן דו פלואורי הופק לראשונה בשנת 1929 באלקטרוליזה של אשלגן פלואורי מותך וחומצה הידרופלואורית בנוכחות כמות קטנה של מים. כיום מפיקים את החומר בתגובה של פלואור עם נתרן הידרוקסיד
תגובות
החומר הוא מחמצן חזק בשל דרגת החימצון הלא יציבה של אטום החמצן במולקולה (2+). בטמפרטורה שמעל 200°C חמצן דו פלואורי מתפרק לחמצן ופלואור.
OF2 יגיב עם מתכות ויתקבלו תחמוצות ומלחי פלואוריד, תגובה עם זרחן נותנת PF5 ו POF3, עם גופרית יתקבל SO2 ו SF4.
חמצן דו פלואורי יגיב כמחמצן אפילו עם הגז האציל קסנון
בתגובה עם מים מתקבלת חומצה הידרופלואורית (HF)
זהירות
הגז נחשב לגז בלתי יציב עקב תכונותיו כמחמצן חזק. חומצה הידרופלואורית, שמתקבלת כתוצאה מהידרוליזה של התרכובת עם מים, היא חומר משתך ורעיל ביותר אשר יכול לגרום לנקרוזיס, לספיחת סידן מהעצמות וכן לנזק ללב ולמערכת כלי-הדם.
קישורים חיצוניים
חמצן דו-פלואורי32527040Q411301



