משאבת לב מלאכותי LVAD
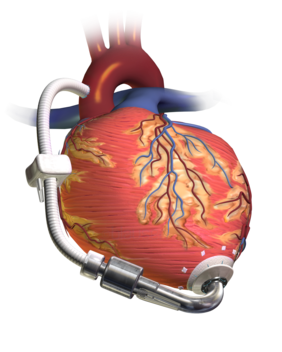
משאבת לב (באנגלית VAD – ventricular assist device) היא מכשיר אלקטרוני מכני המושתל בליבו של חולה ומסייע בתפקוד הלב כאשר ישנו קושי. בדרך כלל בעת אי ספיקת לב. המשאבה יכולה להחליף את תפקוד הלב באופן מלא או באופן חלקי, והיא מותאמת אישית לחדר בו יש בעיה (RVAD לחדר ימין, LVAD לחדר שמאל וBIVAD לשני החדרים). המשאבות הנפוצות ביותר הן משאבות חדר שמאל ולרוב הן יעילות יותר לתפקוד לקוי. לרוב ניתן לשפר את תפקוד הלב כולו בעזרת משאבת חדר שמאל אך בעת התנגדות רבה של העורק הפולמונרי נצרף משאבה לחדר ימין. משאבות אלו עושות פעולה שונה ממכתיב קצב לב, הן פשוטו כמשמעו תורמות בהזרמת דם המטופל לכל חלקי הגוף. משאבות אלו משמשות למספר תפקידים, הן לתקופה קצרה עד בינונית בשביל המתנה להשתלת לב, חיזוק לב לאחר דלקת או התקף לב, או עזרה למטופלים המתאוששים מניתוח לבבי, והן לתקופה ארוכה (חודשים עד שנים) כי המטופל אינו מתאים להשתלת לב.
ניתן לחלק את השימוש במשאבות למספר סוגי טיפול אותם מכנים כ"גשרים ל". גשר להשתלה – שימוש נפוץ לתקופה בינונית, המשאבה מעלה את איכות חייהם של ממתינים להשתלת לב. בצורה זו אין הם חייבים לשהות בבית החולים. בנוסף לטיפול מסוג זה יש עוד מספר גשרים: גשר למועמד שאינו קביל להשתלה אך קרוב לכך, גשר עד החלטה האם להיכנס לרשימת המתנה או לא, גשר להתאוששות ממחלה או ניתוח. סגנון נוסף של טיפול אשר מיועד לזמן רב ונקרא טיפול ייעודי, במצב זה המטופל יחייה עם משאבת לב עד סוף חייו – הן בגלל חוסר התאמה להשתלה או בחירה לכך. זה אינו נחשב לב מלאכותי על פי הרפואה המודרנית, אלא הליך טיפולי התורם ללב הקיים.
מבנה ופעולה
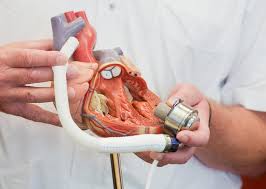
מדובר במכשיר שתפקידו הכללי הוא הזרמת דם למערכת הקרדיווסקולרית כאשר ישנו קושי בתפקוד חדר שמאל של הלב. המכשיר מבוסס על משאבה אשר מניעה את הדם בכוח דרך צינור אל האאורטה. עוצמת המשאבה היא שקובעת את מהירות זרימת הדם בגוף. חוץ ממשאבה וצינור המחובר אל האאורטה יש יחידת שליטה אשר קובעת את מהירות המשאבה, מספקת מדדים שונים ומתריעה על תקלות שונות. החיבור בין המשאבה ליחידת שליטה נעשה על ידי כבל, אשר עובר דרך בטנו של המטופל. ליחידת שליטה מחבורות שתי סוללות אשר מספקות אנרגיה קבועה למכשיר.[1]
כיום, הרפואה משתמשת בשני סוגי מכשור, כאשר לפעולה זו יש משמעות לאופי המשאבה מבחינת טיפול:
- משאבות המדמות דופק – עושות שימוש בשיטת בוכנה, הן שואבות נוזל למיכל ובעזרת לחץ מזרימות אותו החוצה. חלקן עושות שימוש בלחץ אוויר כדי לבצע פעולה זו.
- משאבות זרימה קבועה – פועלות בשיטה צנטריפוגלית. הן משאבות שפועלות בצורה קבועה ולא משתנה. אלו משאבות קטנות יותר.
בערך זה נעמיק במשאבות זרימה קבועה.
ברפואה המודרנית נעשה שימוש בדור השלישי של משאבות אלו. נרחיב מעט על החלקים שתיארנו במבוא לפסקה זו. באופן כללי הן מורכבות מ־3 חלקים עיקריים
- משאבה – מושתלת בחזה באזור האפקס של הלב בהליך כירורגי. בנקודה זו היא מקבלת דם ומזרימה אותו אל האאורטה בעזרת צינור.
- כבל שליטה ובקרת שליטה – המשאבה מחוברת בעזרת כבל למערכת השולטת על תפקודה, מהירותה ובקרת תקלות. הכבל מחובר למשאבה עצמה ודרך חור בבטן מחובר למערכת הבקרה (נקודת תורפה במערכת).
- ספק כוח – זוג סוללות המחברות באופן קבוע. ישנה אפשרות גם לספק כוח ממקור נייח (כניסת חשמל בקיר או ברכב).
בפירוט ניתן לחלק את חלקי המכשיר לחלקים פנימיים וחיצוניים
חלקים פנימיים – משאבה, צינורית הזרמת הדם לאאורטה, כבל כוח פנימי.
חלקים חיצוניים – כבל כוח חיצוני, יחידת שליטה ושתי סוללות.
ברפואה המודרנית עושים שימוש במשאבות בעיקר מהדור ה-3 אשר קיבלו אישור מהFDA- הHEARTMATE 3 והHEARTWARE. מכשירי הדור השלישי מבוססים על משאבות צנטריפוגליות. החידוש שלהם ביחס לדורות הקודמים הוא תפקוד לזמן רב, קומפקטיות וזרימת דם אופטימלית, דבר המונע קרישיות דם והרס של תרומבוציטים. בזכות נתונים אלו המשאבות יכולות לתפקד בין 5 ל-10 שנים ברצף ללא תקלות הדורשות החלפה.
קומפקטיות המכשיר מאפשרת ניתוח קל יותר ביחס לקודמים ופחות פגיעה בחלקים פנימיים של המטופל. כל חלק בעל חשיבות רבה לתפקוד המכשיר אך החלקים הפנימיים דורשים פעולה כירורגית כדי לתקן תקלה בהם, דבר אשר מקשה מאוד על תיקון זריז ודורש התחשבות רבה בעת החדרת המכשור.
הפעולה הצנטריפוגלית – כמו שהזכרנו לפני משאבות זרימה קבועה בדור השלישי פועלות בצורה צנטריפוגלית – זהו כוח מדומה המושך גוף הנתון בתנועה מעגלית לאורך רדיוס הסיבוב בכיוון הפונה החוצה ממרכז המעגל. לגוף בתנועה סיבובית יש מהירות קווית בכיוון המשיק למעגל בסיבוב וכיוון זה משתנה. עיקרון ההתמדה קובע כי גוף שואף להתמיד בתנועה ישרה בכיוון המשיק, לכן הגוף נמשך כלפי חוץ הסיבוב. משיכה זו היא הכוח הצנטריפוגלי. כדי לקיים תנועה מעגלית חייב להיות כוח המושך את הגוף כלפי מרכז הסיבוב. כוח זה נקרא כוח צנטריפטלי. זהו אינו כוח מדומה אלא כוח אמיתי הניצב למהירות. כוח זה משנה את כיוונו אך לא את גודלו. החלק אשר גורם לתנועת הסיבוב המייצר כוח זה הוא האימפלר – הגלגל המניע, במשאבה. הוא מסתובב במהירות גבוהה בעזרת אנרגיה המופעלת עליו – אנרגיה חשמלית או מגנטית. נוזל נכנס אל המשאבה ובעזרת הסיבוביות של הגלגל המניע יוצא בחוזקה ונע לכל חלקי הגוף הנדרשים.[2]
בשתי המשאבות יש שימוש בריחוף מגנטי – בשיטה זו אנו משתמשים באנרגיה מגנטית בצורה של דחיה של השדה המגנטי, מצב זה מאזן את כוח תאוצת הכובד המושך כלפי מטה והחפץ נשאר יציב באוויר ללא מגע. הבנה זו מאוד יעילה לשימוש במכשור אשר דורש תנועה רבה – הוא מוריד את רמת החיכוך ומאפשר תנועה במהירות מאוד גבוהה. בריחוף מגנטי יש לשים לב לשני דברים כדי לעשות זאת בצורה טובה – ריחוף וייצוב באותה נקודה. ריחוף – ניתן להסביר בפשטות על ידי דחייה של שני מגנטים בעלי אותו דיפול. אם תנסו זאת שני המגנטים לא יתחברו כי הם דוחים אחד את השני. ואם נשים אח מעל השני הגבוה ירחף. דחייה זו אינה יציבה, לכן המגנט המרחף ינוע ימינה או שמאלה ובסופו של דבר לא יהיה הופכי לתאוצת הכובד, דבר אשר יפסיק את הריחוף (הריחוף מתרחש עקב איזון עם תאוצת הכובד) דבר זה הוכח על ידי תאוריית ארנשואו. האיזון נעשה בעזרת יציבות – כל תזוזה מנקודת שיווי המשקל מפעילה רשת כוחות אשר דוחה ומחזירה את המשוואה לאיזון בנקודת השיווי משקל.[3]
את היכולת לייצר יציבות נחלק ל-2:
יציבות סטטית – נעשית על ידי מגנטים מיוחדים. מגנטי דיפול קלאסיים כמו שאנו מכירים אינם יציבים בצירים השונים ואילו דיאמגנטים יציבים בציריהם ולכן ניתן לבצע זאת בעזרתם. בנוסף ניתן לשנות את החוסר איזון בעזרת תנועת אלקטרונים למערכת. נחבר את המגנטים למוליכים ונשלוט בתנועתם.[4]
יציבות דינמאית – יציבות אשר מתרחשת לאחר הפעלת כוח על המערכת. זאת אומרת שהמערכת תדע לספוג הפעלה חיצונית של אנרגיה. יש מספר דרכים לעשות זאת כמו הפעלת לחץ אוויר שייצב את המערכת או ההנעת אלקטרונים שייצבו את המערכת.[5]
הגלגל המניע ממוקם בתוך המשאבות בשיטה זו וכך נמנע מצב של שפשוף חלקי המשאבה והארכת חייה.
עתה נפרט מעט על שני המכשירים וההבדלים ביניהם -
HEARTWARE – מכשיר המשמש כיום גם כמכשיר תמיכה עד השתלת לב ומכשיר המחליף תפקוד לב לזמן רב. אושר לראשונה בשנת 2012 על ידי הFDA.[6]
המשאבה – שוקלת 140 גרם, וגובהה הוא 53 מ"מ. מורכבת מבית משאבה, IMPELLER וINFLOW CANNULA.
המשאבה של ה-HEARTWARE קטנה יותר ממשאבות קודמות בשוק דבר המקל משמעותית על החדרתה בעת ניתוח. היא מושתלת בסמוך ללב בחלל הפריקרדיאלי בזכות גודלה הקטן הדומה לגודלו של כדור גולף.
IMPELLER – למכשיר זה יש רק חלק אחד המבצע תנועה והוא ממוקם בתוך בית המשאבה, הוא נקרא IMPELLER – זהו גלגל ברזל אשר מסתובב ומניע את הדם בצנרת המכשיר בתנועה צנטריפוגלית. הוא מסתובב במהירות של 1800 עד 4000 סיבובים לדקה ויכול להזרים עד 10 ליטר דם בדקה.
האימפלר מושעה בתוך בית המשאבה באמצעות שילוב של מגנטים פסיביים ומיסב דחף הידרודינמי. מיסב הדחף ההידרודינמי מושג באמצעות שכבה דקה של נוזל הדם בחלקו העליון של חרבות האימפלר. כאשר הוא מסתובב דם זורם בחלק העליון של האימפלר ומייצר אזור רך בין המשאבה לאימפלר המונע פגיעה בחלקי המכשיר.
INFLOW CANULLA – צינורית קטנה המשולבת במשאבה שכל תפקידה הוא מיקסום כניסת הדם אל המכשיר. חלק זה מוחדר אל הלב ומקל על תהליך ההשתלה. דרכו זורם הדם אל האימפלר שמניע את הדם דרך צינורית אל האאורטה. עקב תנועה של חלק בודד במכשיר והעובדה כי המשאבה מבצעת מעט סיבובים לדקה המכשיר בעל כושר עמידות ותפקוד רב. בנוסף לכך יש מערכת שליטה מאוד נוחה, עם מסך LCD בעל שני פסים, מערכת התראות ונוריות למקרה הצורך. המערכת מחוברת לשתי סוללות כמו מכשירים אחרים בשוק ויכולה בעת הצורך להתחבר לספק כוח נייח כמו שקע חשמלי או שקע ברכב. מכשיר זה יחסית חדש בשוק ולפי סטטיסטיקות שונות שיפר את איכות החיים של מטופלים רבים.
HEARTMATE 3- מכשיר זרימה צנטריפוגלי המנוע על יד מגנטים. הוא מסתובב במהירות של 3000 עד 9000 סיבובים לדקה וגם הוא מזרים עד 10 ליטר דם לדקה. משאבה זו גם היא מוגדרת כמשאבה מתמשכת היא משנה את מהירות הסיבוב לפרקים כדי לייצר תנועות דופק מלאכותיות המסתנכרנות עם דופק הלב של אותו אדם כדי למנוע עמידה של הדם. המשאבה שוקלת 240 גרם ויכולה להכיל נפח של 175 מ"ל. היא ברובה בנויה מטיטניום חוץ מנקודות שונות של פוליאסטר וטבעות PTFE בחיבורים. היא מורכבת מצינורית כניסת דם וצינורית יציאת דם, צינורית הורדת לחצים בדם ואת כל כבלי בקרת השליטה שהזכרנו לפני. הסוללות של מכשיר זה שוקלות כחצי קילו כל אחת. מרקם המשאבה וצורתה נועדו לגרום להיווצרות של שכבה דמוית אינטימה בעת מגע עם הדם ובכך לבודד מגע של חומרים לא ביולוגיים מזרם הדם ולמנוע היווצרות של קרישי דם. לעומת זאת החלק הרוטור (חלק מסתובב המניע את הדם) בנוי מחומרים חלקים בעלי משטח עדין. בצורה זו אנו מורידים את הסיכוי לגיזרה עקב לחץ על הרוטור. חברה זו נמצא בשוק זמן רב ומכשיריה הוכיחו עצמם עד כה, הם מאוד יעילים ובעלי ניסיון דבר המשפר את תפקודה. מכשיר זה בעל צג מאוד נוח למשתמש עם הרבה הסברים התורמים גם למטפל במניעת תקלות. כיום מפתחים משאבות נוספות אף קטנות יותר כדי לאפשר איכות חיים גבוהה אף יותר ממה שיש למטופלים כיום כי עיקר הבעיה במכשור היא החדרה כירורגית לא קלה וטיפול בתקלות במהלך חיי המטופל.[7]
שימושים
השימוש במכשיר יכול לשמש לגשר להשתלת לב, במטרה להאריך את חיי המטופל עד שתרומת לב תהיה זמינה, כגשר להחלטה, בדרך כלל עד שהמטופל יתאושש ויהיה כשיר במידת האפשר בכדי לעבור ניתוח להשתלת לב, וכיעד קבוע לטיפול, מטרה שנכנסה עד לאחרונה הודות לפיתוחים טכנולוגיים.
מרבית המטופלים מקבלים את הסיוע לחדר שמאל, כאשר במצב חמור יותר של 15% תבוצע השתלה גם לחדר ימין שמזרים דם אל עורק הריאה. נתון מעניין נוסף הוא כי בארץ קיימים כ־1,000 מטופלים עם בעיית אי ספיקת לב חמורה, מתוכם מגיעים ל־130 שעומדים לקריטריונים המאוד מחמירים, ורק כ־20 מטופלים עוברים בשנה השתלת לב.
גשר להשתלה – מטופלים אלו, לזמן הרחוק מקבלים את הסיוע של המכשיר, לאחר שעבור התקף לב חמור שהביא להתדרדרות מתמדת של הלב, אך בגלל אי הזמינות של תרומת לב הם אינם יכולים לחכות בלי טיפול מסייע עד להשתלה. לפי נתונים של ארגון השתלות הלב העולמי, כ־50% מבין המועמדים להשתלת לב, מתים במצב בו אין טיפול רפואי. דבר שמחזק את חשיבות המכשיר.
גשר להחלטה – מספר לא מבוטל של מטופלים מקבלים את סיוע המכשיר כדי להרוויח זמן להתאוששות המטופל או במצב שבו מקור הבעיה שפוגעת בתפקוד הלב אינו ידוע, ויש צורך "להרוויח זמן" כדי ללמוד את מצבו של החולה. כך למשל במקרים של חולים שמגיעים לבית החולים לאחר שקרסו בפתאומיות או עברו החייאה, או חולים שהפגיעה הקשה בתפקוד הלב הובילה לפגיעה במערכות אחרות (כגון כליות או כבד) ורוצים לבדוק אם מערכות אלו מתאוששות.
יעד טיפולי קבוע – ככל שנתוני ההצלחה עלו, השימוש במכשיר באופן קבוע עלה באופן בולט. כאשר כיום מדברים על כך שמדובר באלטרנטיבה להשתלה בקרב חולי אי ספיקת לב שנמצאים בשלב סופני ולא מועמדים להשתלה. דור המכשירים הנוכחי הוא יותר עמיד ובעל סיבוכים מעטים, דבר שהביא לכך כי מטופלים יכולים להשתמש בו לטווח ארוך ולהוריד את אחוזי התמותה. בארצות הברית מדברים על עלייה מ־15% בשנת 2006 ל־43% בשנת 2014 בשימוש המכשיר באופן קבוע.
כגשר להחלמה – כיום ישנן עדויות שתומכות בכך כי המכשיר מעודד החלמה של שריר הלב, ההחלמה אפילו מספיקה כדי להסיר את המכשיר ללא השתלת לב ולאפשר למטופל להמשיך את חייו תוך שמירה על איכות חיים נורמלית. כשדבר זה קורה המשמעות כפולה בכך שהלב המיועד לתרומה יכול לשמש מטופל אחר שזקוק לכך. המכשיר לא מושתל במטרה להוות גשר להחלמה, וההחלטה במקרה הזה מתקבלת לאחר מגוון בדיקות אשר שוללות את סיכון חיי המטופל. מבחינת הטיפול חשוב לסייע כי במקביל ישנו סיוע תרופתי ספציפי שעוזר להחלמה של הלב אשר כוללים ace inhibitors, beta blockers, and aldosterone antagonists שתפקידם למנוע פתולוגיות של היפרטרופיה ולהחזיר את התפקוד המטבולי למצב הנורמלי. תרופות אלו ניתנות במינון גבוה, דבר שמתאפשר אודות להתערבותו של המכשיר. כיום המחקר בהחלמתו של שריר הלב מתקדם הרבה בזכות קיומו של המכשיר, בדרך כלל נלקחת דגימה משריר הלב במהלך הכנסת המכשיר והשוואתה לדגימה שנלקחת בעת הוצאת המכשיר, כך מנסים להבין את המבנה המולקולרי שמביא להחלמה של השריר.[8]
עיקרי הסיבות הקליניות לשימוש ב־lvad
- מטופלים שנמצאים במצב רפואי קשה או גיל מתקדם כדי לעבור השתלת לב. בישראל הגיל המקסימלי להשתלת לב הוא 65
- מטופלים שנמצאים ברשימת המתנה להשתלת לב, אך מצבם לא יציב מספיק כדי להמתין לתרומת לב
- מטופלים עם BMI מאוד גבוהה, דבר שמקטין את הסיכוי שלהם לקבל השתלת לב
- מטופלים שנמצאים בשלב מתקדם של מיוקרדיטיס או קרדיומיופטי, או מטופלים עם מחלות לב שמונעות את הצלחת ההשתלה
- מטופלים שעברו ניתוח לה, אך לא יכולים להתנתק ממכונת לב ריאה
- מטופלים שחוו כמות גדולה של התקפי לב, ללא טיפול מסייע אחר
מחקר ה־Rematch כמחקר מפתח בתחום המחקר התפרסם בשנת 2001, בכתב העת הרפואי New England journal of medicine בו השתתפו 129 חולים עם אי ספיקת לב מתקדמת שאינם מועמדים להשתלה בגלל גיל מבוגר, מחלות נלוות אחרות ועוד. החולים חולקו בצורה אקראית לכאלו שטופלו ב־LVAD וכאלו שטופלו תרופתית בלבד. החוקרים הראו ירידה של 48% בתמותת חולי ה־LVAD עם שיעור היוותרות בבחיים של 52% בקבוצת ה־LVAD לעומת 25% בטופלים תרופתית לאחר שנה. לאחר שנתיים שרדו 23% בקבוצת ה־LVAD ו־8% במטופלים תרופתית. המחקר הראה גם שיפור באיכות החיים בקבוצת ה־LVAD. במחקר זה נעשה שימוש ב־LVAD של חברת טורטק, הנקרא HeartMate 1 היות שהמכשיר לא תוכנן במקור לתמיכה ממושכת של שנים, במהלך המחקר התגלו כמה תקלות טכניות שגרמו לכישלון המכשיר, ובחלק מהמקרים אף למות החולים. חברת טורטק הכניסה כמה שינויים במכשיר והיום הוא מאושר לשימוש בישראל בגרסה המשודרגת שלו.[9]
היסטוריה
בתחילת שנות ה־50' החל השימוש במכונות מלאכותיות הקשורות למערכת הסירקולטורית. השימוש הראשוני החל על ידי ג'ון גיבסון (John Gibbons) שהצליח לתמוך במטופל על ידי מכונת לב ריאה מחוץ לחדר הניתוח. בעקבות התפנית שנצפתה, החלו מטפלים לרבים להשתמש בשיטת תמיכת לב- ריאה במטופליהם מחוץ לכותלי חדר הניתוח.
המכון הלאומי לבריאות הציבור בארצות הברית, רצה להשקיע את רוב מאמציו במציאת פתרון לבעיות סירקולריות. המשימה הראשונה שיושמה היא ייצור לב מלאכותי (TAH) בקליניקה בקליבלנד ובנוסף על ידי ליאוטה בארגנטינה. בשנת 1963 דווח לראשונה על חיבור מעקף מלאכותי בין החדר השמאלי לאורטה היורדת. בתחילה הניסויים נוסו על בעלי חיים, לאחר שנראה כי הדבר מוביל לפגיעה ולזיהומים תשומת הלב הושמה למקורות אחרים.[10]
הניסיונות להחליף את הלב הביולוגי בלב מלאכותי JARVIK 7-TAH לא צלחו. המטופל הראשון שאליו הושתל הלב המלאכותי, בשנת 1982, שרד רק 112 יום, מכיוון שסבל מאלח דם שנבע מכשל במספר מערכות. בעקבות כך, הובן כי החלפת הלב בלב מלאכותי אינו ישים, ואף מסב נזק, לכן הוחלט לנסות ולעבוד על מכשיר חיצוני שיהווה תמך ללב ולא תחליף כולל והמשיכה העבודה על הLVAD – תוך דגש על מציאת פתרון לטווח הרחוק.
המשאבה הראשונה שהומצאה, עבדה על העיקרון עבודה במקביל למסלול הדם השני שקיים (הצד הימני של הלב). כוח המשאבה הופק מאלקטרוניקה או מכוח של לחץ האוויר שנכנס אל הריאות. משאבה זו נוצרה ב־1966 על ידי די באקיי ( De Bakey) ושותפיו המציאו את הLVAD. המשאבה הייתה מחוברת עם צינורית אל החדר השמאלי של הלב, עבודתה יכלה להתמקד בצד השמאלי, בצד הימני או לעבוד בשניהם. אם היה צורך בתמיכה של שני החדרים, המשאבות היו ממקומות מחוץ לגוף (מטעמי מקום), אם היה מדובר רק בצד אחד העניין התאפשר וכלל את סוג המשאבה. המשאבה הראשונה הושתלה כ־BTT (גשר מעבר להשתלת לב), השילוב הראשון בין יישום גשר ההשתלה בעזרת המשאבה נראה לראשונה בשנת 1984. בעקבות המצאת המכשיר נוצרו הזדמנויות חדשות לחולי לב, אנשים יכלו לחיות עם משאבת הלב עד שיגיע תורם לבצע את הניתוח ולחיות. למרות יתרונותיה, המשאבה הראשונה כללה בתוכה הרבה מאוד חסרונות, היא הייתה גדולה, רועשת מאוד, יצרה נוזלים בקרום של הלב ואף הובילה לשחיקת המסתמים, דבר שעלול להוביל לפגיעה פאטלית. בעקבות חסרונותיה של המשאבה הראשונה, היה צורך בפיתוח של מכשיר מתקדם יותר מבחינה מכנית (רצון לאפשר זרימה רציפה) ואסתטית. לכן, פיתחו בשנות ה־90' משאבה שעובדת על תנועה צירית בשילוב של שדה מגנטי. הדור השני של המשאבה מותאם רק לשימוש בצד השמאלי ולא הותאם עדיין לשימוש של שני הצדדים. הדור השני של המשאבה עשוי ממדחף שעטוף בקפסולה מטלית, הדבר מאפשר את הארכת החיים של המשאבה (מינימום חמש שנים). הניסוי הקליני הראשון שנעשה על המשאבה נעשה על 133 משתתפים שהמתינו להשתלת לב. תחילה נצפה כי במהלך 126 הימים הראשונים יש הישרדות של 75%, לאחר כחצי שנה נראתה הישרדות של 68% אחוזים ואילו לאחר שנה נראה כ־52% הישרדות. המשאבה השנייה יצאה לשוק בשנת 2001 על ידי חברת Thoratec.[11]
החל משנת 2008 ישנו אישור של ה־FDA להשתמש בדור השני של המשאבה כגשר עד ניתוח להשתלת לב, החל משנת 2010 ישנו אישור לשימוש במשאבה לטווח הרחוק. המשאבה השנייה שיפרה את איכות חייהם של המון מטופלים, גרמה לשיפור בתפקוד האנדרוגני, בנוסף עבור מספר מטופלים התאפשר לחזור לחיים רגילים ואף לעבודה. בעת ניתוח החדרת המשאבה השנייה לא היה צורך לפתוח את בית החזה, מכיוון שניתן היה לבצע פתיחה צדדית ולהשתיל את המשאבה מאזור הצלעות. למרות יתרונותיה של המשאבה השנייה מבחינת ייעול עבודתה ונוחות, היא הובילה לבעיות בתפקוד הצד הימני, דימום, התקפי לב, קרישיות ועוד, לכן נדרש לחשוב על פתרונות ייעול במשאבה אחרת.
הדור השלישי של המשאבה תוכנן מכיוון שהיה צורך להקטין את גודלה של המשאבה, לשנות את הנראות שלה ולמזער נזקים לצדדים כן פעילים בלב. הדור השלישי אפשר בזכות הקטנת הגודל לא רק שיפור בנראות, אלא גם השתלת משאבה דו צדדית פנימית. המשאבה עובדת על כוחות מגנטיים והידראוליים, בזכות כך אין צורך לבצע שינויים במכשיר במשך 10 שנים. הפטנט של הכנסת המשאבה בצורה לטראלית נשאר ונשמר אחרי הדור השני של המשאבה. ההספק המקסימלי של המשאבה הוא 10 ליטר לדקה. המשאבה השלישית יודעת לשנות את דפוסי הפולסים שלה לפי המהירות של החוגה, הדבר מוביל למניעה מקסימילית של סיכון המורוגי או טרומבוליטי. בנוסף, בזכות השדרוג של המשאבה ניתן להשתיל מיני תומך לצד הימני של הלב, ללא ניתוק של הלב והריאות בפרוצדורה ניתוחית מסובכת, הדבר מאפשר תמיכה וחיזוק הצד הימני. הדור השלישי של המשאבה נוסה החל משנת 2014 ואושר על ידי ה־FDA בשנים 2017-2018.[12]
אבני דרך עיקריות
- האדם ששרד הכי הרבה זמן עם משאבת הלב הראשונה, עבר את הניתוח להשתלת המשאבה ביוני 2000, אך נפטר בשנת 2007 מפגיעה בכליה, עד מותו פיטר הצליח לנהל בזכות המשאבה שגרת חיים רצויה ואיכותית.
- בין השנים 2001 ל־2004 נעשו ניסוי על ידי התאגיד אשר פיתח את המשאבה וכלל כ-38 משתתפים באזור גיל ה־48, נבדקו במשך 96, נצפה 70% הצלחה במהלך ההמתנה להשתלת לב.[13]
- במחקר שנערך במשך חצי שנה החל מיוני 2006, נמצא כי חולי לב שעברו השתלה בי לטראלית הראו יותר תופעות לוואי, לעומת מושתלי משאבה רק בצד השמאלי, בעקבות כך הוחלט לשקול יותר לעומק השתלה בי־לטראלית.
- בין השנים 2007–2010 נעשה מחקר שנקרא (HARPS ( Harefield Recovery Protocol Study. מטרת המחקר הייתה לבדוק האם ישנה האפשרות לשקם את הלב תוך שימוש במשאבה (LVAD) יחד עם תרופות לשיקום הלב (β2 agonist) בלקיחה אוראלית, לאחר מכן לבחון את האפשרות כי מטופל ייגמל מהמשאבה, ישקם את ליבו שלו ואף ימנע מהשתלת לב עתידית. בניסוי השתתפו 18 משתתפים, נראו 94.4% הצלחה, אך הרבה מטופלים סבלו מתופעות לוואי רבות.[14]
- לראשונה בשנת 2010 הושתלה המשאבה השנייה בגבר בן 74 בבית חולים "הכרמל" בחיפה.[15]
- לראשונה המשאבה השלישית הושתלה בארץ בשנת 2016 בבית החולים שיבא "תל השומר" בגבר בן 53 [16]
- בשנת 2018 לראשונה הושתלה המשאבה השלישית בישראל בילד בבית החולים "בילינסון".[17]
- במחקר שנעשה במרץ 2018 נבדק האם יש השפעה רבה יותר למשאבה צנטרפוגלית או צירית (ללא קשר האם הכוונה הסופית היא שיקום הלב או המתנה להשתלת לב חדש), נמצא כי כ-60% מהחולים עם המשאבה הצנטרפוגלית הראו שיפור לעומת 17% חולים שהראו שיפור עם משאבה צירית.
מהלך הניתוח

בממוצע אורכו של הניתוח הוא 4–8 שעות. מרבית הניתוחים נקבעים מראש, אך יש ניתוחים שקורים באופן דחוף. במהלך ההשתלה, מבוצע חיתוך של עצם הסטרנום, העצם המרכזית בבית החזה, כדי לאפשר גישה ללב במהלך הניתוח. במהלכו של הניתוח, כדי לשמור על תפקוד תקין של הלב, מחברים את המטופל למכונת לב ריאה. הניתוח מתמקד בשני מקומות אנטומיים בבית החזה של המטופל והם נקודת השיא של הלב המכונה גם "apex" לשם תתחבר המשאבה ולחלק העולה של האורטה המכונה "ascending aaorta". במהלך הניתוח יחבר המנתח צינור בין שתי נקודות אלו, כך שהדם אשר מוזרם לחדר שמאל של הלב יגיע ישירות לאבי העורקים אשר יזין את הגוף בדם עשיר בחמצן ויהווה תחליף לאי תפקודו של לב שמאל. לאחר הניתוח, יופנה המטופל לחדר התאוששות, כאשר בדרך כלל הוא ישהה במחלקת טיפול נמרץ לב למשך שבוע, כדי לוודא שהניתוח עבר בהצלחה.[18]
סיכונים לאחר השתלת LVAD
משאבת LVAD מעבר להיותה גשר להשתלת לב, משמשת כטיפול היעד עבור חולים עם אי ספיקת לב קשה. למרות השימוש ההולך וגובר, המשאבות עדיין מהוות אתגר לרפואת החירום.[19]
כשל חדר ימין – כשל חדר ימין הוא סיבוך אפשרי לאחר השתלת LVAD המוריד את סיכויי ההישרדות של המטופל בכ-20%. מחקר מטה־אנליזה שפורסם, הראה שכיחות של כשל חדר ימין בכ־35% בקרב מושתלי LVAD, והוגדר על ידי INTERMACS כמקושר ללחץ ורידי גבוה. לעיתים קרובות, כשל חדר ימין מתגלה כבר במהלך הניתוח ומצריך השתלה נוספת של RVAD. לעיתים, כשל חדר ימין יתגלה בהתאוששות בחדר טיפול נמרץ לאחר הניתוח ויבוא לידי ביטוי בלחץ דם נמוך, תפוקת לב נמוכה ומתן שתן ירוד.
דימום ממערכת העיכול – הדימום הכי שכיח במושתלי LVAD הוא ממקור GI (מערכת העיכול). מטופלים לאחר ניתוח מקבלים טיפול תרופתי הכולל נוגדי קרישיות (Anti-coagulant), אשר עלול להחמיר דימומים קיימים. לעומת זאת, אצל מושתלים אשר אינם מטופלים באנטי־קואגלנטים, דימום ממערכת העיכול הוא נדיר. על מנת להימנע מדימום שכזה, על המטופלים לעבור בדיקות מקיפות הכוללות קולונוסקופיה ואנדוסקופיה בכדי לזהות דימומים פוטנציאלים (פוליפים, אולקוס וכו') במערכת העיכול בטרם הניתוח ולטפל באותם מקורות.
קריש דם במשאבה ושבץ – סיכון נוסף לאחר השתלת LVAD הוא חסימה של המשאבה על ידי קריש דם. שכיחות סיכון זה, דווחה על ידי INTERMACS כעומדת על 5%, נכון לשנת 2015, בששת החודשים לאחר השתלת LVAD מסוג heartmate 2. סימפטומים לחסימת המשאבה כוללים קוצר נשימה במאמץ והמטוריה (דם בשתן המשקף המוליזה). תוצאות מעבדה יצביעו על אחוז גבוה של המוגלובין לא רווי ואחוז גבוה של LDH. המשאבה עצמה תפעל בעוצמה רבה יותר ותציג דופק נמוך. חסימה במשאבה לעיתים מתאפיינת בשבץ מוחי או ב־TIA. סיכון זה פוחת משמעותית בהשתלת דור שלישי של HeartMate לעומת דור שני.
זיהומים – יכולים לקרות בכל מקום מסביב למשאבה המושתלת, בין אם זה בקנולה המחברת בין חדר שמאל למשאבה ומהאאורטה למשאבה ובין אם זה ברקמות דרכם עובר חוט החשמל בדרכו החוצה מהגוף – זיהום שכיח יותר עקב האינטראקציה המוגברת של רקמות אלו עם הסביבה החיצונית. הפתגונים השכיחים הגורמים לזיהומים בעור סביב חוט החשמל היוצא הם חיידקים מסוג Staphylococcus aureus ו־coagulase-negative staphylococci, בעוד שפתוגנים הקשורים לזיהומים סביב המשאבה באזורים פנימיים הם: Serratia, Klebsiella, and Enteroccocus species, Pseudomonas aeruginosa
הפרעות קצב – סיכון שכיח לאחר השתלת LVAD, במיוחד בתקופה המיידית לאחר הניתוח. מדיווח INTERMACS עולה כי 14.8% מהמושתלים חוו הפרעות קצב ב־30 ימים שלאחר הניתוח, בעוד ש־5.2% חוו הפרעות קצב גם לאחר תקופת זמן זו. ההנחה היא כי המנגנון שגורם להפרעות הקצב הוא מיקום המעגל החשמלי של המשאבה על גבי תאי שריר הלב (מיקרדיום) שהיו פגומים בטרם הניתוח ולכן הקיצוב לא עבד.
יתר לחץ דם – באופן כללי, למושתלי LVAD אין לחץ דם סיסטולי או דיאסטולי ולכן לחץ הדם העורקי הממוצע (MAP) נקבע על ידי דופלר. יתר לחץ דם במושתלי LVAD מוגדר כ-MAP הגבוה מ־90 ממ"כ, מצב שיוביל לסיכון גבוה יותר לשבץ ועלול להכשיל את פעולת המשאבה. לחץ הדם יכול להיות מבוקר אצל המטופלים על ידי טיפול תרופתי של מעכבי ACE, חוסמי בטא וכו'. מטרת הטיפול היא לשמור על לחץ דם ממוצע של 60–70 ממ"כ.
אפידמיולוגיה של סיכוני LVAD
הסיכון האופייני ביותר לאחר השתלת LVAD הוא דימום. עד כ־70% ממושתלי LVAD יחוו סיבוך של דימום פנימי במהלך שנותיהם עם המשאבה, אם כי דימום המצריך התערבות כירורגית אינו נפוץ.
זיהום הוא הסיבוך השני בשכיחותו, מופיע אצל 30–50 אחוז מהמטופלים. זיהומים לאחר השתלת LVAD כוללים זיהומים הקשורים ישירות למשאבה וזיהומים ספטים שלא קשורים ישירות למשאבה אך קורים בתדירות גבוהה יותר אצל מושתלי LVAD.
שבץ מוחי (איסכמי > המורגי) שכיח יותר במושתלי LVAD בכ־15% יותר ממטופלים ללא LVAD, נכון לשנת 2012.
סיבוכים הקשורים למשאבות, כתוצאה מכשל במשאבה עצמה, אינם שכיחים, אך קורים. דוגמאות לסיבוכים אלו הם סתימה במשאבה (1.4%–5% למושתל לשנה, תלוי בסוג המכשיר) ואי ספיקת לב ימנית.[20]
קישורים חיצוניים
- Intermediate- and long-term mechanical circulatory support by Emma Jane Birks, MD, PhD, FRCP - up to date
- Magnetic levitation by WIKIPEDIA
- שימושים חדשים במשאבה מלאכותית התומכת בחדר השמאלי )LVAD (בחולים עם אי־ספיקת לב מתקדמת ד"ר בנימין מדליון המחלקה לניתוחי לב וחזה, מרכז רפואי רבין, קמפוס בילינסון והפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב
- Journal of Thoracic Disease - Left ventricular assist devices—current state and perspectives
- Journal of Thoracic Disease - Left Ventricular Assist Devices (LVADS): History, Clinical Application and Complications.Howard J. Eisen, MD, FACC, FACP, FAHA, FAST, FHFSA, FESC
- PubMed - Two-Year Outcomes with a Magnetically Levitated Cardiac Pump in Heart Failure
- PubMed - Results of a multicenter clinical trial with the Thoratec Implantable Ventricular Assist Device
- Harefield Recovery Protocol Study for Patients With Refractory Chronic Heart Failure (HARPS) - CLINICALTRIALS.GOV
- אתר שיבא - לראשונה בישראל: השתלת לב מלאכותי חדשני, המילה האחרונה בתחום החלופות ללב אנושי
- לראשונה בישראל: הושתל לב מלאכותי בילד בן 11 - MAKO
- ynet - לראשונה בישראל: השתלת לב מלאכותי זעיר (ד"ר איתי גל)
- Lvad surgery - UTSMED.org
הערות שוליים
- ↑ https://www.youtube.com/watch?v=k6rs1pRM6lg
- ↑ כוח צנטריפוגלי
- ↑ https://en.wikipedia.org/wiki/Magnetic_levitation
- ↑ https://en.wikipedia.org/wiki/Magnetic_levitation
- ↑ https://en.wikipedia.org/wiki/Magnetic_levitation
- ↑ https://www-uptodate-com.ezproxy.bgu.ac.il/contents/intermediate-and-long-term-mechanical-circulatory-support?search=LVAd&source=search_result&selectedTitle=5~89&usage_type=default&display_rank=5
- ↑ https://www-uptodate-com.ezproxy.bgu.ac.il/contents/intermediate-and-long-term-mechanical-circulatory-support?search=LVAd&source=search_result&selectedTitle=5~89&usage_type=default&display_rank=5
- ↑ https://www-uptodate-com.ezproxy.bgu.ac.il/contents/intermediate-and-long-term-mechanica l-circulatory-support?search=lvad%20surgery&topicRef=3466&source=see_link
- ↑ https://www.ima.org.il/Ima/FormStorage/Type3/up-10-04-10.pdf
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4999658/ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6597447/
- ↑ https://pubmed.ncbi.nlm.nih.gov/29526139/ https://pubmed.ncbi.nlm.nih.gov/17532959/
- ↑ https://clinicaltrials.gov/ct2/show/NCT00585546
- ↑ https://stanfordhealthcare.org/medical-treatments/l/lvad.html
- ↑ https://www.ahajournals.org/doi/pdf/10.1161/CIRCHEARTFAILURE.111.962472
- ↑ https://www.sheba.co.il/66635
- ↑ https://www.ynet.co.il/articles/0,7340,L-3956818,00.html
- ↑ https://www.mako.co.il/health-news/local/Article-3ca7ba65ad5a661006.htm
- ↑ https://utswmed.org/conditions-treatments/lvad-surgery/
- ↑ Howard J. Eisen, Left Ventricular Assist Devices (LVADS): History, Clinical Application and Complications, Korean Circulation Journal 49, 2019-06-20, עמ' 568–585 doi: 10.4070/kcj.2019.0161
- ↑ Gage Stuntz, rew Phillips, MD, MedEd, FAAEM, LVAD Part III: Complications, ALiEM, 2020-03-30 (באנגלית)
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] משאבת לב מלאכותי LVAD30027674


