אצטל



אצטל (Acetal) הוא קבוצה פונקציונלית מהצורה R2C(OR')2 כאשר שתי קבוצות ה 'R הן שיירים אורגנים. לאטום הפחמן המרכזי 4 קשרים ולכן הגאומטריה טטראדרלית. שתי קבוצות הR הקשורות לפחמן המרכזי יכולות להיות זהות - אצטל סימטרי או שונות זו מזו. אם שתי קבוצות הR אורגניות (אין אטום מימן הקשור לפחמן המרכזי) הקבוצה נקראת קטאל (ketal).
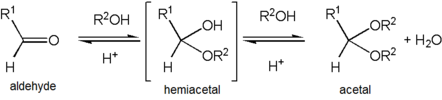
אצטל נוצר התגובה בין המיאצטל לכוהל. מנגנון התגובה כולל פרוטונציה של קבוצת ההידרוקסיל, עזיבה של מולקולת מים, התקפה נוקלאופילית של הכוהל על יון הקרבוניום ואיבוד פרוטון של האלכוהול התוקף.
האצטלים יציבים בהשוואה להמיאצטלים אך יצירתם היא באמצעות תגובות בשיווי משקל. כדי להגיע לניצולת גבוהה יש צורך בסילוק המים הנוצרים בתגובה למניעת הידרוליזה של הוצר חזרה להמיאצטל. בתגובה ליצירת אצטל מספר המולקולות בתוצרים נמוך ממספר מולקולות המגיב כך שהתגובה ההפוכה מועדפת מבחינת האנטרופיה אלא אם כן דיאול מגיב עם האלדהיד או הקטון. כדי להימנע מכך ניתן להגיב את האלדהיד או הקטון עם אסטר במקום עם כהלים כך שהמים הנוצרים בתגובה משמשים להידרוליזה של האסטר ונוצר עוד כוהל המשתתף בתגובה.
אצטלים משמשים כקבוצות הגנה על קרבוניל או דיאול משום שהאצטל יציב למחזרים ומחמצנים שונים.


רוב הקשרים הגליקוזידים ברב סוכרים הם קבוצות אצטל.
קישורים חיצוניים
| קבוצות פונקציונליות | ||
|---|---|---|
| פחמימנים | אלקיל (מתיל, אתיל, פרופיל, בוטיל, פנתיל) • אלקן (ויניל, אליל) • אלקין • קרבן • בנזיל • הלואלקאן • אלן • קומולן • פניל | 
|
| תרכובות חמצן | הידרוקסיל (כוהל) • קרבוניל • קטון • אלדהיד • אציל • קרבונט • חומצה קרבוקסילית • אנהידריד • אסטר • הידרופראוקסיד • פראוקסיד • אתר • המיאצטל • המיקטאל • אצטל • קטאל• חומצה דיקרבוקסילית • אצטיל • אצטוקסי • אקרילואיל • אלקוקסי (מתוקסי) • בנזויל • דיאוקסירן • אפוקסיד • אורתו-אסטר • ינון | |
| תרכובות חנקן | אמין • אמיד • קרבאמאט • אימין • אימיד • אזיד • אזו • ציאנט • איזוציאנט • ציאניד • ניטריל • איזוניטריל • הידרזון • ניטראט • ניטריט • ניטרו • ניטרוסו • אוקסים • פירידין • הידרזון • איזוניטריל • ניטרן | |
| תרכובות זרחן | פוספין • חומצה פוספונית • פוספאט • פוספודיאסטר | |
| תרכובות גופרית | תיול • תיואתר • דיסולפיד • סולפוקסיד • סולפון • חומצה סולפינית • חומצה סולפונית • תיוציאנט • איזותיוציאנט • תיוקטון • תיאל • תיואסטר • סולפונאמיד • פרסולפיד • תיוניל | |
| תרכובות ביוכימיות | חומצת שומן (ח.קרבוקסילית) • חלבון (פולי-אמיד) • פחמימה (קטון או אלדהיד) | |
אצטל22430518Q421103


