חלבון

חלבון (בלועזית: פרוטאין, מיוונית - πρώτειος, פְּרוֹטַאִיוֹס - "ראשוני") הוא תרכובת אורגנית גדולה ומורכבת יחסית, הבנויה משרשרת מקופלת של חומצות אמיניות הקשורות ביניהן בקשרים פפטידיים בין הקבוצה הקרבוקסילית של החומצה האמינית לקבוצה האמינית של החומצה השנייה. בסך הכל יש 20 חומצות אמינו סטנדרטיות שבונות חלבונים בגוף האדם. החלבונים נמנים עם התרכובות החשובות ביותר המרכיבות את האורגניזם, והם מצויים בכל תא חי. הם יוצרים אינטראקציות עם מולקולות מסוגים שונים, כגון חלבונים אחרים, ליפידים, פחמימות, ו-DNA[1][2].
רצף חומצות האמינו בחלבון נקבע על ידי רצף הנוקליאוטידים בגן (מקטעי DNA או RNA) המכיל את המידע להרכבתו. מכלול תכונותיו של האורגניזם נקבע על ידי ההתקשרויות הכימיות של חלבון אחד עם אחר. לחלבונים מבנה תלת-ממדי מורכב ביותר המכתיב את תפקידם ופעילותם בגוף החי.
החלבונים התגלו לראשונה על ידי ינס יאקוב ברצליוס ב-1838 והוא כינה אותם בשמם. אף-על-פי-כן, תפקידם המרכזי של החלבונים באורגניזמים חיים לא הוערך במלואו עד 1926, כאשר ג'יימס סאמנר הראה כי האנזים אוראז הוא חלבון. הרצף הראשון של חלבון שנקבע היה של חלבון האינסולין, על ידי פרדריק סנגר, שזכה בפרס נובל על הישג זה ב-1958. המבנה החלבוני הראשון שפוענח היה של ההמוגלובין והמיוגלובין על ידי מקס פרוץ וג'ון קנדרו, גם כן ב-1958. המבנה התלת-ממדי של שני חלבונים אלו נקבע על ידי אנליזה של שבירת קרני רנטגן.
באשר לכתיב הכימי, הסיבה לכך שבדרך כלל אין נוסחאות שלד (Structural Formula) דו-ממדיות לחלבונים היא בשל גודלם הרב יחסית למולקולות שכן נפוץ לתאר כך. לפני גילוי ה-DNA, נחשב החלבון בטעות לחומר התורשתי שעובר מההורים לצאצאיהם, ושעל פיו מתפתחים התאים וכל חלקי הגוף.
סוגי חלבונים
רוב החלבונים משתייכים לאחת משתי קבוצות עיקריות:
- מבניים: אלו הם החלבונים שמרכיבים את התא, אברוניו, וחלק ממבני הגוף, לדוגמה:
- העור מורכב ברובו (כ-75%) מהחלבון קולגן.
- הפרווה והשיער מורכבים ברובם מקרטין, חלבון טבעי המופיע אצל יונקים.
- משי (אשר מייצר טוואי המשי) וקורי עכביש שניהם חלבונים טהורים, הבנויים ממשטחי בטא.
- מכווצים: בעלי יכולת לייצר תנועה. חלבונים אלו, כגון מיוזין ואקטין, מצויים בשרירים.
- בקרום התא (ממברנת התא) קיימים מגוון נשאים, תעלות ומשאבות שנעים דרך קרום התא ובנויים מחלבונים.
- תפקודיים: אלו הם החלבונים שממלאים את כל התפקידים בגוף, ומתחלקים לתתי-קבוצות:
- מגנים: חלבונים אלו מהווים את הנוגדנים של מערכת החיסון.
- ההמוגלובין הוא חלבון, נמצא בכדוריות דם אדומות, הוא קושר חמצן מהריאות ומעביר אותו לתאי הגוף, ונושא 23% מהפחמן הדו-חמצני מתאי הגוף אל הריאות.
- שליחים: משמשים להעברת אותות מתא לתא; הורמונים (כגון אינסולין), מוליכים עצביים (נוירוטרנסמיטרים, כגון גלוטמאט) וציטוקינים הם חלבונים שליחים (יוצא דופן מבחינה זו הוא גלוטמאט, שהוא חומצת אמינו בודדת, כלומר אחת מאבני הבניין המשמשות להרכבת חלבונים).
- אנזימים: משמשים כזרזים של תגובות כימיות בגוף.
מבנה מרחבי של חלבון

תפקוד החלבון תלוי מאוד בחוזקת המבנה שלו. מבנה זה מתקבל על ידי המערך המדויק של חומצות האמינו המרכיבות אותו. כל חלבון מתקפל במרחב לצורה תלת-ממדית, כתוצאה מקשרים כימיים בין חומצות האמינו השונות. כמו כן, קיימים גם מתחמים בקיפול חלבון אשר מהווים חלוקה נוספת של החלבונים. אלה הם יחידות פוליפפטידיות המתקפלות באופן עצמאי, ללא קשר לקונטקסט החלבוני בו הן נמצאות. למרבית המתחמים חשיבות פונקציונלית או מבנית לתפקוד החלבון. כמו כן, למתחמים בקיפול חלבון יש חשיבות רבה בתיווך אינטראקציות בין חלבונים. את מבנה החלבון מחלקים לארבע רמות בסיסיות:
- מבנה ראשוני: זהו מבנה קווי פשוט, הבנוי אך ורק מהקשר הפפטידי בין חומצות האמינו, ומקשרים די סולפידים. לכל חלבון יש מבנה ראשוני, המוגדר על ידי סדרת הזוויות הדו-מישוריות לאורך השרשרת. הפרעות מרחביות הדדיות בין חומצות אמינו שכנות מאלצות את מרבית הזוויות בחלבון לתחומים זוויתיים מוגבלים, המיוצגים בדיאגרמת ראמהצ'אנדרן.
-
כתוצאה מתכונות כימיות של החומצות האמיניות נוצרים אילוצים על הזוויות פסי ופי. האות אומגה המוצגות באיור מייצגת את זווית הקשר הפפטידי.
- מבנה שניוני: במבנה מיוחד זה נוצרים קשרי מימן בין חומצות אמינו מסוימות (רק חלק מחומצות האמינו מאפשרות מבנה שניוני) הגורמים לשינוי מרחבי המקפל את החלבון לאחת משתי צורות עיקריות: סליל אלפא או משטח בטא.
- סליל אלפא: מבנה זה נוצר כאשר חומצות אמינו יוצרות קשרי מימן עם חומצות אמינו במרחק 3.6 שיירים מהן. קשרים אלו מקפלים את החלבון ב-100 מעלות לכיוון שמאל, רוב החלבונים שנמצאו מקופלים ימינה (כך יש פחות הפרעה סטרית, ראו גם: סטריאוכימיה, כיראליות) וכך נוצר מבנה ספירלי דחוס שבתוכו אין כמעט חלל פנוי. קבוצות ה-R של החומצות פונות כלפי חוץ בסליל אלפא. בממוצע כשליש מכל חומצות האמינו בחלבונים נמצאות בסלילי אלפא.
- משטח בטא: מבנה זה נוצר כאשר שתי שרשרות פוליפפטידיות או יותר נצמדות זה לזה באמצעות קשרי מימן, ויוצרות מבנה דמוי משטח. למבנה זה שני אופנים: מקבילי (פרללי) ואנטי-מקבילי (אנטי-פרללי). במבנה מקבילי, כיוון השרשרות הפוליפפטידיות זהה בשרשרות השונות: קצה אמיני בסמוך לאמיני וקצה קרבוקסילי בסמוך לקרבוקסילי. במבנה אנטי-מקבילי, כיוון השרשרות הצמודות הפוך: קצה אמיני בסמוך לקצה קרבוקסילי וקצה קרבוקסילי בסמוך לאמיני. במבנה האנטי-מקבילי קשרי המימן קצרים יותר ולכן זהו מבנה חזק יותר בהשוואה למקבילי. בממוצע, כרבע מכל חומצות האמינו בחלבונים נמצאות במשטח בטא.
-
סליל אלפא, כל סיבוב מכיל 3.5 חומצות אמינו.
-
משטחי בטא מקבילים מימין, ואנטי מקבילים משמאל. ניתן לראות שיש למשטחי בטא אנטי מקבילים יותר קשרי מימן מאלו המקבלים. תכונה זו מעניקה להם יציבות יחסית גבוהה יותר.
קיימים מספר מבנים שניוניים אחרים, אך אלו פחות נפוצים. כמו כן, לעיתים מקטעי חלבון אינם מאמצים מבנה שניוני אלא מאמצים מבנה בלתי מאורגן (Disordered Region).
- מבנה שלישוני: זהו המבנה התלת-ממדי הכולל שמקנה לחלבון את היכולת לבצע תפקיד ספציפי בתא. הפרעה או פגם ביצירת מבנה זה יפגמו בהכרח בפעולת החלבון. המבנה השלישוני נוצר ממספר סוגים של קשרים כימיים:
- קשרי גופרית (S-S): קשרים קוולנטיים הנוצרים רק בנוכחות חומצת האמינו ציסטאין, המכילה אטום גופרית בקצה קבוצת ה-R. קשרי S-S מכונים קשרים דיסולפידיים (מהמילה Sulphide, "גופרי").
- קשרי מימן: קשרי מימן בין קבוצות ה-R של חומצות האמינו
- קשרים יוניים: אלו הם קשרים בין יונים בעלי מטענים הפוכים זה מזה; מכונים גם גשרי מלח.
- אפקט הידרופובי: חומצות אמינו שלהן קבוצת R הידרופובית (נדחית ממים) עשויות להיצמד יחדיו מתוך דחייה מהמים. זה אינו קשר כימי אלא דחייה משותפת מאותו גורם.
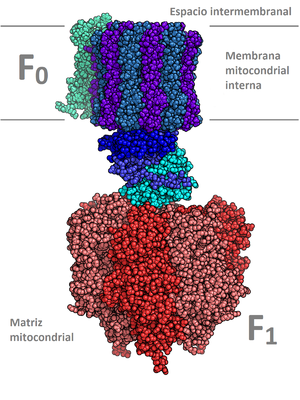
- מבנה רביעוני: מבנה זה הוא תוצאה של אינטראקציה בין לפחות שתי מולקולות חלבון, במצב זה ההתייחסות אל כל מולקולת חלבון היא כתת-יחידה של החלבון המורכב והיא משמשת כחלק מהקומפלקס החלבוני. זהו מבנה מורכב שקיים רק בחלק מהחלבונים. לחלבון במבנה זה יש משקל מולקולרי מאוד גבוה. הקשרים הכימיים היוצרים את המבנה השלישוני עושים זאת גם במבנה הרביעוני. המוגלובין הוא חלבון מוכר הבנוי במבנה רביעוני ולו 4 תתי-יחידות. חלבונים במבנה הרביעוני מסתדרים במרחב בשתי צורות עיקריות:
שינוי קונפורמרי
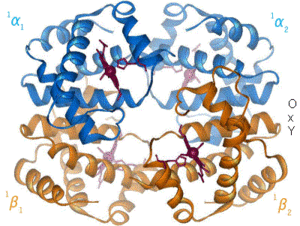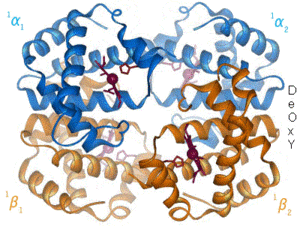
שינוי מרחבי (קונפורמרי) של מבנה החלבון הוא תהליך טבעי בגוף או כתוצאה מגורם סביבתי מחוץ לגוף, שבו משתנה המבנה המרחבי הטבעי של החלבון. השינוי יכול להיגרם עקב שינויים בסביבה של החלבון, כגון עלייה בטמפרטורה, שינוי ברמת ה-pH (חומציות או בסיסיות), יצירת קשר גופרית, שינוי בריכוזי יונים, היקשרות לליגנד, נוכחות של חומרים שונים (למשל תרופות), וכדומה. השינוי המרחבי מכתיב את התפקוד של החלבון, לפיכך, שינוי המבנה המרחבי של החלבון ישנה את תפקודו. למשל, פפסין פעיל אך ורק ברמת pH חומצית כמו שבקיבה, אך אם תשונה הרמה מעבר לטווח התפקוד שלו, הוא כבר לא יהיה פעיל.
יצוין, כי אמנם המבנה הראשוני (היינו, רצף חומצות האמינו) של החלבון מכתיב את המבנה שלו (למעט בנוסף ליצירת קשרי גופרית), אך השינוי הקונפורמרי נובע משינויים בגורמים הנ"ל. שינויים אלו הם קטנים יחסית וזמניים, ובעיקר קורים באתרי קישור של החלבון, שם מתרחש עיקר תפקודו של החלבון.
חלבון יכול להיות בכמה מצבי קונפורמציה בזמנים שונים, ובכל אחד מהם יהיה לו תפקוד שונה.
חלק מהתרופות תפקידן להיקשר לאתרי הקישור של החלבון, אך ללא יכולת התנתקות בשונה מליגנד, ואז משתנה מעט מבנה החלבון, והוא אינו פעיל יותר.
דנטורציה
 ערך מורחב – דנטורציה
ערך מורחב – דנטורציה
דֵּנָטוּרַצְיָה היא תהליך שבו משתנה המבנה המרחבי הטבעי של החלבון למצב מרחבי חסר תפקוד. דנטורציה נגרמת מאותם גורמים הנ"ל אך כאשר הטווח הנורמלי יוצא מאיזון אם בצורה טבעית או בצורה מלאכותית, או בנוכחות קרינה, הגעה לפרוטאוזום כמוות חלבוני מתוכנן, הוספת מרקפטואתנול לתמיסת חלבון, ועוד. דנטורציה גורמת לחלבון לאבד את תפקודו, כלומר, חלבון שאיבד את מבנהו המרחבי הטבעי לא יוכל לבצע את פעילותו עוד. למשל: אנזים (חלבון פעולה שתפקידו לזרז תהליכים ביוכימיים) שנחשף לטמפרטורות שאינן בטווח הטמפרטורות האופטימלי עבורו, יעבור הרס של מבנהו המרחבי (דנטורציה), ועקב כך כבר לא יתאים במבנהו המרחבי לסובסטרט (המצע) שלו ולא יוכל לבצע את תפקידו.
אקסטרמופילים הם חיידקים אשר התפתחו במהלך האבולוציה, ומסוגלים לחיות בתנאים סביבתיים שליצורים אחרים יהיו קיצוניים מדי. זאת הודות לשינוי ביוכימי במבנה החלבונים שמאפשר להם תפקוד ביולוגי תקין בסביבות חיים אלו.
יצירת חלבונים

החלבונים נבנים בתוך התאים על ידי הריבוזומים. בתהליך היצירה של חלבונים, הקרוי תרגום, מתורגם המידע התורשתי המקודד ב-mRNA, שהוא בעצמו משועתק מה-DNA. הגנים המרכיבים את ה-DNA הם, לפיכך, "תוכניות בנייה" לחלבונים. ה-DNA מקודד ליצירת חלבונים באמצעות הקוד הגנטי, כך שכל שלושה נוקלאוטידים (אבני הבניין של ה-DNA) מקודדים לחומצה אמינית אחת (שלושה נוקלאוטידים המקודדים לחומצת אמינו מכונים יחדיו בשם קודון).
שרשרת קצרה של חומצות אמינו מכונה פפטיד; שרשרת ארוכה מכונה פוליפפטיד. לאחר שמיוצר הפוליפפטיד בריבוזום, הוא מתקפל למבנה תלת-ממדי מורכב ברשתית התוך-פלזמית.
תהליך היצירה של חלבון מתחיל בגרעין התא. בתחילה מופרדים שני גדילי הסליל הכפול של ה-DNA בעזרת אנזים. על אחד הגדילים נבנה mRNA. לאחר שהלה נוצר במלואו הוא נפלט לציטופלזמה ומוצמד לאחד מהריבוזומים בתא בעזרת rRNA. הריבוזום מתחיל לקרוא את הקוד הגנטי שמכיל ה-mRNA. כאשר הריבוזום מזהה את סוג החומצה האמינית הנחוצה לפי הקוד הגנטי, הוא מושך אליו tRNA הנושא חומצה אמינית מתאימה, ומוסיף אותה לשרשרת חומצות האמינות שכבר נוצרה. כאשר ייווצר הקשר הבא בשרשרת החומצות האמיניות ישוחרר ה-tRNA לציטופלזמה כדי להיצמד לחומצה אמינית חדשה המתאימה לו. כך נבנית השרשרת עד שהחלבון מושלם. לאורך יצירת שרשרת חומצות האמינו משוחררים חלקים מושלמים מהשרשרת לציטופלזמה עד שכל החלבון המושלם משוחרר (לעת עתה במבנה ראשוני בלבד). בקצותיו של ה-RNA השליח נמצאים קטעים שאינם מקודדים חומצות אמינו; תפקידם הוא לסמן את תחילתו וסופו של החלבון.
חומצות האמינו מסתדרות בדרכים שונות במבנה שניוני. לאחר מכן מתבצע תהליך של קיפול למבנה שלישוני. מבנה זה בנוי ממתחמים. לבסוף, מבשיל החלבון ומקבל את צורתו הסופית שהיא המבנה הרביעוני. לעיתים הבשלת החלבון כוללת גם קטיעה של מקטעים מסוימים שלו, הוספה של קבוצות כימיות כסוכרים, זרחה, קבוצות גופרית ושומנים. כמו כן, לעיתים החלבון חובר לחלבונים אחרים, רצועות RNA או ליונים ליצירת קומפלקס חלבוני פעיל. בעשורים האחרונים חלה התקדמות כבירה בהבנת המבנה המרחבי של חלבונים על ידי שיטות של גיבוש חלבונים והדמיית תהודה מגנטית במסגרת תחום מחקר הקרוי ביולוגיה מבנית. המדע העוסק בחקר החלבונים, בפעילותם ובקשרי הגומלין ביניהם נקרא ביוכימיה.
תפקידי החלבונים

להוציא סוגים מסוימים של RNA, רוב המולקולות הביולוגיות הן אינרטיות יחסית. החלבונים הם אלה שאחראים לרוב הפעילות בתא, והתפקידים שלהם נקבעים ב-DNA[3].
- חלבוני ממברנה - "תעלות", "משאבות"
- חלבוני מבנה - לדוגמה: קרטין, קולגן (בונה סחוס)
- חלבונים מתכווצים - בונים תאי שריר
- חלק מההורמונים - חלבונים שמעבירים מסרים בגוף (מתא לתא)
- נוגדנים - חלבונים ש"תוקפים" חומרים זרים
- אנזימים - חלבונים המזרזים פירוק או בנייה של חומרים אחרים בתאים. האנזימים מזרזים בכמה סדרי גודל את מהירות התגובות הכימיות שדרושות לקיום חיים. ללא האנזימים תגובות אלה לא יקרו במהירות מספקת. על פי רוב, האנזימים הם ספציפיים, והם מזרזים רק תגובה כימית אחת או שתיים. הם מבצעים את רוב האינטראקציות שמעורבות במטבוליזם ופועלים על הדנ"א בתהליכים כגון שכפול, תיקון ושעתוק. ישנם אנזימים שפועלים על חלבונים אחרים כדי להוסיף או להסיר קבוצות כימיות בתהליך שנקרא מודיפיקציה פוסט-תרגומית.
זיהוי חלבונים
 ערך מורחב – שיטות חלבונים
ערך מורחב – שיטות חלבונים
זיהוי חלבונים בתמיסה והפרדתם
שיטות רבות ושונות משמשות לזיהוי נוכחות של חלבונים בתמיסה. מכיוון שרוב החלבונים מסיסים במים, על מנת לזהות את נוכחותם בתמיסה יש לרוב צורך בריאגנט כימי (למשל ריאגנט ברדפורד) או ביולוגי (למשל נוגדנים) הנקשר אל מולקולות החלבון בתמיסה. שיטה נוספת לזיהוי חלבונים בתמיסה היא ספקטרוסקופיית UV, המסתמכת על העובדה ששיירים בעלי טבעות ארומטיות בולעים קרינה אלקטרומגנטית בתחום האולטרה-סגול. שיטות כאלו מאפשרות את זיהוי החלבון בתמיסה ואף מאפשרות קביעה מדויקת למדי של כמות החלבון בתמיסה; ואולם, תמיסות ממקור ביולוגי מכילות לרוב תערובת של סוגים שונים של חלבונים, ולכן קיימות שיטות רבות אף יותר להפרדת החלבונים השונים הקיימים בתמיסה.
המכנה המשותף לרוב השיטות הללו הוא שהן מתמקדות על מאפיין אחד של החלבון - למשל הנקודה האיזואלקטרית שלו, ומפרידות בין החלבונים על סמך מאפיין זה. על בסיס זה קיימות שיטות רבות ושונות כמו כרומטוגרפיה לסוגיה (לצורך זה משמשים מכשירי ה-FPLC וה-HPLC), הפרדה באמצעות ג'ל (שיטות כגון SDS-PAGE, ג'ל פילטרציה וג'ל דו־ממדי), שיקוע באמצעות מלחים קלי-תמס (למשל אמוניום סולפט) ועוד רבות ושונות.
קיימות כיום שיטות מתקדמות יותר המאפשרות גילוי ובידוד של חלבון ספציפי, בהתבסס על שיטות אימונולוגיות. שיטות אלו, אשר המשותף להם הוא השימוש בנוגדנים בעל ספציפיות לחלבון המבוקש, מאפשרות זיהוי פשוט ומהיר של החלבון המבוקש ברמת דיוק גבוהה; ואולם, חסרונן של שיטות אלו הוא עלותן הגבוהה (עקב העלות הדרושה להפקת נוגדנים) וכן העובדה שקשה להשתמש בהן על מנת להפריד את החלבון מהתמיסה. בנוסף, התקדמויות בתחום ההנדסה הגנטית מאפשרות ליצור חלבון בעל אזורים מסוימים שיכולים לסייע בהפרדתו מהתמיסה (למשל הוספת 'תגיות' היסטידין אשר מאפשרות הפרדה באמצעות קולונת ניקל).
ריצוף וקביעת מבנה
על מנת לאפיין לחלוטין חלבון, יש צורך לדעת מהו רצף חומצות האמינו שמרכיבות אותו, וכן מהו המבנה התלת-ממדי (מבנה שלישוני או רביעוני) שלו.
את רצף החלבון מגלים לרוב בשיטות גנטיות, מכיוון שהחלבון מיוצר בתאים על ידי תרגום ולכן פשוט יותר לקבוע את רצף הרנ"א השליח המקודד לו. השיטה הרווחת ביותר לקביעת רצף החלבון מבוססת על חיתוך החלבון למקטעים קצרים (פפטידים), הפרדתם באמצעות תמיסה ולבסוף מדידת משקלם הגולמי באמצעות ספקטרומטר מסה. ניתן לחזות את רצף חומצות האמינו של כל פפטיד ומסתו מראש על פי רצף ה־DNA או ה־RNA שעל פיו יוצר החלבון.
את המבנה מגלים לרוב בשיטות של קריסטלוגרפיה באמצעות קרני רנטגן או תהודה מגנטית גרעינית; שיטות אלו מאפשרות ליצור תמונה תלת־ממדית של מבנה החלבון, באמצעות מיקום האטומים הבודדים המרכיבים אותו (תמונות אלו זמינות לקהל הרחב בפורמט PDB, ראשי תיבות של Protein Data Base, או מאגר המידע החלבוני).
רפואה
רוב רובן של כ-4,000 המחלות התורשתיות הגנטיות הידועות לרפואה קשורות לתפקוד לקוי או להיעדר תפקוד של חלבון מסוים בגוף. חשיבותם העצומה של החלבונים לחיים מודגשת באופן מצער באמצעות הנזק הרב העלול להיגרם לגוף עקב חוסר תפקודו של חלבון בודד; הדבר מראה כי אף על פי שבגוף פועלים עשרות אלפי חלבונים שונים, לכל אחד מהם תפקיד ספציפי ביותר והחלבונים האחרים אינם מסוגלים בדרך-כלל לחפות על חוסר תפקודו של חלבון מסוים.
במחלות גנטיות קיים פגם - מוטציה - ברצף הנוקלאוטידים שב-DNA. הפגם עשוי לגרום ל:
- ייצור חומצת אמינו שגויה
- השמטת חומצת אמינו מהשרשרת החלבונית
- הפסקת קידוד הגן במקום בו התרחשה המוטציה, ועקב כך לייצור חלבון חלקי, קצר מהרגיל
עובדה זו מראה שבנוסף לחשיבותו של כל חלבון לתפקוד הגוף, קיימת גם חשיבות עליונה לכל חומצת אמינו בודדת בשרשרת המרכיבה את החלבון. החלפה או היעדר של חומצה בודדת, אפילו בחלבונים המורכבים ממיליון חומצות אמינו בסך-הכל, יכולה לשבש לחלוטין את תפקוד החלבון. כפי שהוסבר לעיל, הקיפול השלישוני של החלבונים, אשר מכתיב ברובו את תפקוד החלבון, תלוי בקשרים כימיים בין החומצות השונות; כשאחת החומצות המשתתפות בקשרים אלו לא קיימת, המבנה התלת-ממדי של החלבון נפגם, ועמו התפקוד.
בין המחלות התורשתיות הנגרמות עקב חלבונים פגומים ניתן למנות את אנמיה חרמשית, סיסטיק פיברוזיס, עיוורון צבעים, לבקנות, פנילקטונוריה ועוד.
בעשורים האחרונים התגלו חלבונים פגומים המסוגלים לגרום לחלבונים אחרים להפוך לפגומים. חלבונים אלו, הקרויים פריונים, גורמים לכמה מחלות מוח קשות, שסופן תמיד מוות.
החלבון בתזונה



החלבון הוא חומר מזין חשוב לבריאות האדם ולרוב בעלי החיים, המספק את צורכי הגוף לחומצות אמינו. לפי השנתון הסטטיסטי לישראל, בשנת 2006 כמחצית מכמות החלבון הגיע לישראלי הממוצע ממזונות צמחוניים והחצי השני הגיע ממזונות מן החי[4]. צריכה מספקת של חלבון חיונית לתהליכי בנייה, שימור וגדילה אופטימליים של הגוף, ובעיקר השרירים. בעלי החיים ממחלקת היונקים (בהם האדם) לא מסוגלים לסנתז את כל חומצות האמינו הדרושות להם, ולכן נדרשים חלבונים בתזונה שלהם כדי לרכוש את החומצות שאין באפשרותם לסנתז - קרי חומצות אמיניות חיוניות. מקורות מזון עשירים בחלבון הם קטניות, אגוזים, זרעים, בשר, דגים, ביצים, מוצרי חלב.
ישנן תשע חומצות אמיניות שהגוף אינו יודע לייצר בעצמו (חומצות אמינו חיוניות) ועל כן צריך לקבלן בתזונה.
חלבון מלא הוא מזון המכיל את כל תשע חומצות האמינו החיוניות, לרוב זהו מזון מן החי. חלבון חסר הוא מזון שאין בו את כל התשע, בעיקר אלו מזונות מן הצומח[5].
להלן חומצות האמינו החיוניות:
מחסור בחלבון
כמות החלבונים הנדרשת בדיאטה משתנה לפי גיל, מין, משקל, רמת פעילות הגופנית, והמצב הבריאותי. ההמלצה היומית (RDA) היא צריכה של 0.8 גרם חלבון ליום לכל קילוגרם משקל גוף. לאנשים העוסקים בספורט ובפיתוח גוף מומלצת צריכה גבוהה יותר של חלבונים, בין 1.2 ל-1.7 גרם. לתינוקות מומלץ לצרוך 2.2 גרם לכל קילוגרם[6].
דיאטה מערבית טיפוסית רוויה בחלבון מן החי. גם הצמחונים והטבעונים צורכים כמויות סבירות של חלבון מן הצומח בעולם המפותח. כתוצאה מזה סכנת במחסור בחלבון איננה קיימת כמעט בעולם המערבי למעט מצבי מחלה כמו אנורקסיה. מחסור בחלבון מזוהה יותר עם רעב וקיים בעיקר בארצות העולם השלישי.
חסרים בחלבונים יכולים להוביל לתחושת עייפות, לפגיעה בקצב ההתפתחות הפיזית והמנטלית, לעמידות לאינסולין, לנשירת שיער, לאיבוד הפיגמנטים של השיער, לאיבוד ממסת השריר, לירידה בכושר שחלוף רקמות חלבוניות, לטמפרטורת גוף ירודה, לצמצום בייצור אנזימים והורמונים, לאי-סדירות הורמונלית, לאיבוד אלסטיות העור, לפגיעה במערכת החיסונית ובפוריות. חוסר חמור יותר בחלבונים, כמו זה המתבטא בעת רעב המוני, הוא קטלני (כמו בתסמונת הקוושירקור).
תסמונת קוושירקור מתפתחת לרוב אצל תינוקות כתוצאה ממחסור בחלבון לאחר ההיגמלות מההנקה. אם המחלה לא מטופלת, גוף האדם אינו מסוגל לטפל בזיהומים וכתוצאה מכך עשוי להידרדר מצבו ואף להגיע למוות.
סכנות בצריכת יתר
צריכה מוגזמת של חלבונים נקשרה לבעיות הבריאותיות הבאות:
- תגובות מוגזמות במערכת החיסונית.
חלבונים מסוימים יכולים לעורר תגובות אלרגיות. זאת משום שהמבנה של כל סוג חלבון שונה, כאשר חלק עשויים לעורר אלרגיות והשאר יתקבלו בלי בעיות.
- ירידה בתפקוד הכליות
יש הטוענים כי עודף של חלבונים עלול לגרום בטווח הארוך גם לפגיעה בתפקוד הכליות עקב עודף פעילות שלהן. עם זאת, מטא-אנליזה שנערכה מצאה שאין לכך השפעה[7], למעט חריגים בעלי לקות שמונעת מהגוף לפנות את האמוניה שנוצרת מהתפרקות החלבון[8].
- דלדול העצם
עודפי חלבון עשויים לגרום לדלדול העצם כיוון שעודף חומצות אמינו בדם מעלה את רמת ה-Ph בדם, ועל כן הגוף מוציא מהעצמות סידן בכדי לאזן את החומציות.
ממחקר שנערך בנושא למשך שנה עלה כי לתזונה עשירה בחלבון אין השפעות מזיקות[9][10].
קישורים חיצוניים
- חלבון, באתר אנציקלופדיה בריטניקה (באנגלית)
- חלבונים - באתר "ספר הכימיה הווירטואלי" של מכללת אלמהרסט (באנגלית)
 חלבונים, דף שער בספרייה הלאומית
חלבונים, דף שער בספרייה הלאומית
הערות שוליים
- ↑ Brändén, Carl-Ivar, 1934-, Introduction to protein structure, 2nd ed, New York: Garland Pub, 1999
- ↑ Mathews, Christopher K., 1937-, Biochemistry, 2nd ed, Menlo Park, Calif.: Benjamin/Cummings Pub. Co, 1996
- ↑ Molecular cell biology, 4th ed, New York: W.H. Freeman, 2000
- ↑ השנתון הסטטיסטי לישראל, 2008
- ↑ https://veg.co.il/art4.html חלבון מהצומח - אתר הצמחונות והטבעונות הישראלי
- ↑ יובל קסוטו, .M.Sc, חלבון: מקורותיו וצריכה מספקת, מתוך "החינוך הגופני והספורט" כרך נ"ה 3, אדר א'-ב', פברואר 2000 בהוצאת מכון וינגייט לחינוך גופני ולספורט
- ↑ Changes in Kidney Function Do Not Differ between Healthy Adults Consuming Higher- Compared with Lower- or Normal-Protein Diets: A Systematic Review and Meta-Analysis, pubmed, 1 בנובמבר 2018
- ↑ Urea Cycle Disorders Overview, ncbi.nlm.nih.gov, 29 באפריל 2003
- ↑ A High Protein Diet Has No Harmful Effects: A One-Year Crossover Study in Resistance-Trained Males, pubmed, 11 באוקטובר 2016
- ↑
 עשו לנו בושות גדולות בצינור!! (וזאת התגובה.), סרטון בערוץ "Levy's Fit (LBSEP)", באתר יוטיוב (אורך: 9:41), 11 בדצמבר 2024
עשו לנו בושות גדולות בצינור!! (וזאת התגובה.), סרטון בערוץ "Levy's Fit (LBSEP)", באתר יוטיוב (אורך: 9:41), 11 בדצמבר 2024
| קבוצות פונקציונליות | ||
|---|---|---|
| פחמימנים | אלקיל (מתיל, אתיל, פרופיל, בוטיל, פנתיל) • אלקן (ויניל, אליל) • אלקין • קרבן • בנזיל • הלואלקאן • אלן • קומולן • פניל | 
|
| תרכובות חמצן | הידרוקסיל (כוהל) • קרבוניל • קטון • אלדהיד • אציל • קרבונט • חומצה קרבוקסילית • אנהידריד • אסטר • הידרופראוקסיד • פראוקסיד • אתר • המיאצטל • המיקטאל • אצטל • קטאל• חומצה דיקרבוקסילית • אצטיל • אצטוקסי • אקרילואיל • אלקוקסי (מתוקסי) • בנזויל • דיאוקסירן • אפוקסיד • אורתו-אסטר • ינון | |
| תרכובות חנקן | אמין • אמיד • קרבאמאט • אימין • אימיד • אזיד • אזו • ציאנט • איזוציאנט • ציאניד • ניטריל • איזוניטריל • הידרזון • ניטראט • ניטריט • ניטרו • ניטרוסו • אוקסים • פירידין • הידרזון • איזוניטריל • ניטרן | |
| תרכובות זרחן | פוספין • חומצה פוספונית • פוספאט • פוספודיאסטר | |
| תרכובות גופרית | תיול • תיואתר • דיסולפיד • סולפוקסיד • סולפון • חומצה סולפינית • חומצה סולפונית • תיוציאנט • איזותיוציאנט • תיוקטון • תיאל • תיואסטר • סולפונאמיד • פרסולפיד • תיוניל | |
| תרכובות ביוכימיות | חומצת שומן (ח.קרבוקסילית) • חלבון (פולי-אמיד) • פחמימה (קטון או אלדהיד) | |
| אבות המזון | |
|---|---|
|
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
חלבון40156864Q8054





