הכלאת אורביטלים אטומיים
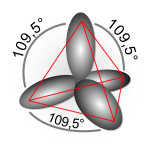
בכימיה קוונטית ובמכניקת הקוונטים, הכלאת אורביטלים אטומיים (מכונה גם היברידיזציית אורביטלים) היא ערבוב של האורביטלים של אטומים היוצרים קשר כימי, כלומר מולקולה, זה עם זה.
האורביטלים, שהם מסלולי האלקטרונים במרחב, מתערבבים, או מכליאים האחד את השני, כדי ליצור אורביטלים חדשים שמתאימים למולקולה במקום האורביטלים הנפרדים שמתאימים לאטומים בודדים.
בניסוח פיזיקלי של מכניקת הקוונטים, האורביטלים המוכלאים הם המצבים העצמיים של המולקולה, במקום האורביטלים הנפרדים שהם המצבים העצמיים של האטומים.
אורביטל בכלל, ואורביטל אטומי בפרט, מייצג את ההסתברות של האלקטרון להימצא בנפח מסוים על פני זמן מסוים. לכן הכלאה אטומית היא חישוב מחדש של ההסתברויות הללו בהינתן הקשר הכימי המתגבש, מעיין יישום של חוק בייס לעולם הכימיה הקוונטית, כאשר הנתון הוא הקשר הכימי.
תיאור הכלאת אורביטלים משמש להבנת הקשר בין המבנה הגאומטרי של המולקולה, לבין פערי האנרגיה באורביטלים האלקטרוניים שלה.
כללי יסוד לשימוש בהכלאה אורביטלית
הכלאה אורביטלית יעילה מאוד כשמדובר באורביטלים המתקבלים עבור אלקטרון לו תנע זוויתי נמוך, כלומר אורביטלי s ואורביטלי p.
כדי להיעזר בהכלאה אורביטלית להבנה מלאה של רמות האנרגיה במולקולה נדרש ידע מעמיק בתורת הקוונטים. עם זאת, ניתן להשתמש בה להבנת הצורה המולקולרית, והבנה חלקית של רמות האנרגיה על פי כמה כללים בסיסיים:
- כיווניותו של כל אטום במולקולה קובעת את מספר האורביטלים המוכלאים
- כאשר בכל אטום זוג אלקטרונים לא קושר מוסיף לכיווניות 1, כל קשר יחיד כפול או משולש מוסיפים גם הם כל אחד אחת לכיווניות. (למשל במולקולה מתאן CH4- לפחמן יש ארבעה קשרים לכן כיווניותו 4, במולקולת המים H2O לחמצן ישנם שני זוגות אלקטרונים לא קושרים ושני קשרים לכן כיווניותו אף היא 4. במולקולת החנקן N2, לכל אטום ישנו קשר משולש אחד וזוג אלקטרונים לא קושר אחד, לכן כיווניותו תהיה 2. ההיברידיזציה בסופו של דבר היא כזו:
- (כיווניות פחות אחד)×(אורביטלי P) + (אורביטלי S)
- כל קשר יחיד במולקולה מייצג אורביטל מולקולרי מסוג אורביטל סיגמא
- קשר כזה נקרא גם קשר סיגמא. כאשר קשר סיגמא נוצר רק מחפיפה בין אורביטלי s או מחפיפה בין הכלאה של אורביטל s ואורביטל p.
- בכל קשר כפול במולקולה, הקשר השני מייצג אורביטל מולקולרי מסוג אורביטל פאי
- קשר כזה נקרא גם קשר פאי. קשר פאי נוצר רק מהקבלה בין אורביטלי p.
דוגמה: ניתוח ההכלאה האורביטלית של אטום פחמן במולקולת אֶתֶן

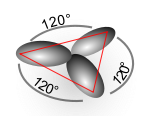
דוגמה טובה לכך היא מולקולת האֶתֶן, במולקולה זו כל אטום פחמן נקשר לשלשה אטומים אחרים משלושה כיוונים שונים, לכן כיווניותו שלוש, כלומר עליו להיעזר בשלושה אורביטלים ובארבעה אלקטרונים. עבור כל אטום פחמן ישנם שני קשרים יחידים וקשר כפול אחד. הקשר הכפול חייב להיווצר מהקבלה של אורביטלי פאי, ושני הקשרים היחידים נוצרים מחפיפה בין אורביטלי סיגמא.
מבט בטבלה המחזורית מגלה את ההערכות האלקטרונית של אטום פחמן במצב היסוד (לארבעת האלקטרונים העליונים)-
- 2s22px12py12pz0
הכיווניות 3 לכן עלינו לערבב שלשה אורביטלים, כאשר לפחות אחד מהם חייב להיות s, ועל פי הנוסחה: (הכיווניות פחות אחת)×(אורביטלי P) + (אורביטליS) המדובר הוא בהכלאה בין שני אורביטלי p ואורביטל s אחד, נהוג לסמנה כ sp2. נוצרו שלושה אורביטלים חדשים, כל אחד מהם sp2. לידיעת אכלוס האלקטרונים בהם יש לדעת את גובה האנרגיה שלהם, שאותה ניתן לאמוד בעזרת חישובי תוחלת - משקלי אורביטלי ה p הוא שני שלישים, ומשקל אורביטל ה s הוא שליש לכן האנרגיה של האורביטלים המעורבבים היא: שליש מהאנרגיה של אורביטל s ועוד שני שלישים מהאנרגיה של אורביטל p.
כעת נוצרו שלושה אורביטלי sp2 נמוכים באנרגיה, ואורביטל P אחד נותר מעליהם באנרגיה, האכלוס החדש צריך להיות: sp2 2 sp2 1 sp2 1 p 0, אלא שכדי ליצור את הקשרים אחד האלקטרונים עובר עירור והתוצאה היא sp2 1 sp2 1 sp2 1 p 1
לכן מצאנו במולקולת אֶתֶן סביב אטום הפחמן- 3 קשרי סיגמא, כל אחד נוצר מחפיפה של אורביטלי sp2. וקשר פאי אחד, שנוצר מהקבלה בין שני אורבטלי 2p. וכן ניתן להעריך בצורה גסה את המאזן האנרגטי מההברידיזציה- לפני ההיברידיזציה היו שני אלקטרונים באורביטל s ו2 באורביטל p. אחריה היו 4 אלקטרונים בשני שלישים הדרך בין אורביטל s וp. כלומר 2 אלקטרונים טיפסו שני שלישים של הדרך, ושני אלקטרונים ירדו שליש הדרך, כלומר בסה"כ המולקולה הפסידה כמות אנרגיה הזהה לשני שלישים פער האנרגיה בין אורביטלי 2p ל 2s. (הרווח האנרגטי מתהליך זה, יתגלה בעת יצירת הקשר הכימי אז חפיפת האורביטלים תהפוך את התהליך לאקסותרמי).
כללי אצבע של הכלאת אורביטלים
יש לפשט ערך זה: הערך מנוסח באופן טכני מדי, וקשה להבנה לקהל הרחב.
| ||
| יש לפשט ערך זה: הערך מנוסח באופן טכני מדי, וקשה להבנה לקהל הרחב. | |
שימוש פשוט בתוצאות של התורה נעזר בכללי אצבע של הכלאה אורביטלית:
- חוק שימור האורביטלים - מספר האורביטלים המעורבבים הוא מספר האורביטלים שנוצרו. בדוגמת האתן, עלינו ליצור שלושה אורביטלים, לכן נערבב שלושה אורביטלים. חוק זה נכון מסיבות חישוביות: כל אורביטל הוא בעצם וקטור עצמי של ההמילטוניאן של המולקולה, המילטוניאן זה נפרש על בסיס שעוצמתו כעוצמת האורביטלים המעורבבים, וכיוון שלמטריצה הרמיטית nXn יש n וקטורים עצמיים, מספר הווקטורים העצמיים שווה למספר וקטורי הבסיס.
- הכיווניות היא סכום המעריכים - מכיוון שנהוג לכתוב את מספר האורביטלים המעורבבים בכתב עילי (למשל בדוגמה של אתן שני אורביטלי p ואורביטל s נכתבים כ: sp2) קל לסכום את המספרים בכתב העילי, וסכום זה צריך להיות שווה לכיווניות. לדוגמה במקרה של אתן, sp2, ה"מעריך" של s הוא 1, ה"מעריך" של p הוא 2 לכן 2+1=3, היברידיזציה זו טובה לכל אטום בעל כיווניות 3.
- האנרגיה מצייתת לחוק המנוף - האורביטלים החדשים נמצאים בתווך בין האורביטלים הישנים, וקרוב יותר לאורביטל ממנו ערבבנו יותר, ביחס ישר. למשל, בדוגמה של אתן ערבבנו שלשה אורבטלים לכן עלינו לחלק את הפער לשלש יחידות. היחס בין האורבטלים הישנים היה 1:2 אורביטלי s:p, לכן גם האנרגיה נמצאת בשני שלישים הפער בין s לp. חוק המנוף משמש במקרה זה משום שהוא הצגה אחרת של חישוב תוחלת.
קישורים חיצוניים
הכלאת אורביטלים אטומיים38803551Q274511


