ליתיום אלומיניום הידריד
 | |
| מבנה כימי של ליתיום אלומיניום הידריד | |
 | |
| בקבוק המכיל כ-100 גרם של ליתיום אלומיניום הידריד | |
| שם סיסטמטי | Lithium alumanuide |
|---|---|
| מסה מולרית | 37.95 גרם/מול |
| מראה | אבקה גבישית מונוקלינית בצבע אפור-לבן |
| צפיפות | 0.917 גרם/סמ"ק |
| מצב צבירה | מוצק |
| מסיסות | מגיב באלימות (בתהליך אקסותרמי) עם מים וממסים פרוטים אחרים תוך פליטת גז מימן |
| נקודת הבזק |
125 °C 398.15 K |
| LD50 | 85 (עכבר) מ"ג לק"ג |
| NFPA 704 | |
ליתיום אלומיניום הידריד (Lithium aluminium hydride) הוא תרכובת אי-אורגנית עם הנוסחה הכימית LiAlH4.
ליתיום אלומיניום הידריד משמש כראגנט חיזור בעל חשיבות רבה מאד בכימיה אורגנית סינתטית. בדרך כלל החומר משמש לחיזור של אסטרים, חומצות קרבוקסיליות ואמידים.
ליתיום אלומיניום הידריד הוא בסיס חזק שמגיב באלימות עם ממסים פרוטים, כגון מים, תוך יצירה של גז מימן.
תכונות פיזיקליות
ליתיום אלומיניום הידריד הוא אבקה קריסטלינית מונוקלינית במצבה הטהור, עם צפיפות של כ-0.917 גרם לסמ"ק. לעיתים הצבע אפור בשל נוכחות של אבקת אלומיניום שנשארה מתהליך הייצור. החומר עובר פירוק (decomposition) בטמפרטורה של מעל 125 מעלות צלזיוס.[1]
ליתיום אלומיניום הידריד מסיס בדיאתיל אתר (30 גרם ל-100 גרם) וטטרה הידרו פוראן (13 גרם ל-100 גרם), אך מסיס בקושי בדיאוקסאן (1 גרם לליטר).[2]
הכנה
ליתיום אלומיניום הידריד הוכן לראשונה על ידי תגובה של ליתיום הידריד עם אלומיניום כלורי:[3]
4 LiH + AlCl3 → LiAlH4 + 3 LiCl
ייצור החומר בתעשייה הכימית מתבסס על שני שלבים. בשלב הראשון מגיבים נתרן, אלומיניום וגז מימן לקבלת נתרן אלומיניום הידיריד, ובהמשך תרכובות זו מגיבה עם ליתיום כלורי לקבלת ליתיום אלומיניום הידריד ונתרן כלורי.
Na + Al + 2 H2 → NaAlH4
NaAlH4 + LiCl → LiAlH4 + NaCl
שימושים
בכימיה האי-אורגנית
ליתיום אלומיניום הידריד משמש להכנת הידרידים של מתכות מעבר מההלידים המתאימים שלהן. לדוגמה, נתרן הידיריד (NaH) יכול להיות מיוצר על ידי תגובה של ליתיום אלומיניום הידריד עם מלח של נתרן כלורי:[2]
LiAlH4 + 4 NaCl → 4 NaH + LiCl + AlCl3
ליתיום אלומיניום הידריד מגיב עם ליגנדים ליצירת קומפלקסים קואורדינטיביים של אלומינה עם יוני ליתיום:[2]
LiAlH4 + 4NH3 → Li[Al(NH2)4] + 4H2
ליתיום אלומיניום הידריד בתגובה עם סילן:[3]
LiAlH4 + SiCl4 → LiCl + AlCl3 + SiH4
כאמצעי לאחסון מימן (Hydrogen storage)
ליתיום אלומיניום הידריד מכיל כ-10.6% משקלי של מימן, לכן הוא עשוי לשמש כמדיום פוטנציאלי לאחסון גז מימן עבור רכבים המונעים בתאי דלק.
בכימיה אורגנית
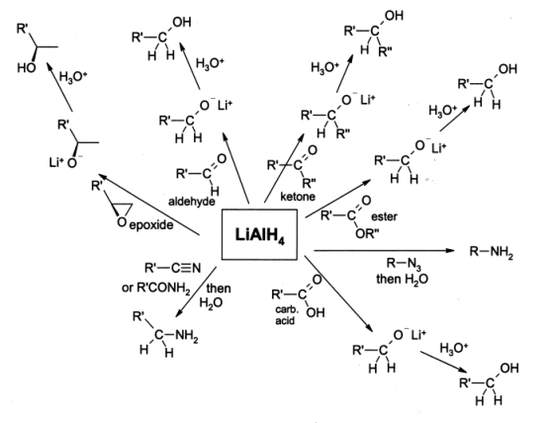
ליתיום אלומיניום הידריד משמש רבות בכימיה אורגנית כראגנט חיזור, בעל עוצמה חזקה יותר מאשר נתרן בורן הידריד (בשל קשרי ה-Al-H החלשים יותר מקשרי הB-H).[4] ליתיום אלומיניום הידריד מסוגל להמיר אסטרים, חומצות קרבוקסיליות, תרכובות אציל, אלדהידים וקטונים לכהלים המתאימים שלהן. באופן דומה, ליתיום אלומיניום הידריד מסוגל להמיר אמידים, ניטרילים, אימינים, אזידים, קבוצות ניטרו, ואוקסים לנגזרות האמינים שלהן.[5]
בטיחות
ליתיום אלומיניום הידריד הוא חומר דליק מאוד. הוא ניצת באופן ספונטני בעת כתישה או חבטה חזקה ומגיב באלימות עם מים וממסים אורגנים פורטים רבים ואף עם אדי מים מהאוויר. כיבוי או דיכוי של שרפה של ליתיום אלומיניום הידריד יכול להיעשות על ידי כיסויי האש בחול, או באבקת אבן גיר (CaCO3) כתושה או בשימוש במטפה מתאים.[2]
ראו גם
קישורים חיצוניים
הערות שוליים
- ↑ msds
- ^ 2.0 2.1 2.2 2.3 Patnaik, P, Handbook of Inorganic Chemicals, McGraw-Hill, 2003, עמ' 492
- ^ 3.0 3.1 Finholt, A. E.; Bond, A. C.; Schlesinger, H. I. 1947, "Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry", Journal of the American Chemical Society. 69 (5): 1199–1203
- ↑ Brown, H. C. 1951, "Reductions by Lithium Aluminum Hydride", Organic Reactions
- ↑ Seebach, D.; Kalinowski, H.-O.; Langer, W.; Crass, G.; Wilka, E.-M. (1991), "Chiral Media for Asymmetric Solvent Inductions. (S,S)-( + )-1,4-bis(Dimethylamino)-2,3-Dimethoxybutane from (R,R)-( + )-Diethyl Tartrate", Org. Synth. ; Coll. Vol., 7, p. 41
ליתיום_אלומיניום_הידריד22523792Q409574


