ניסוי מבוקר הקצאה אקראית
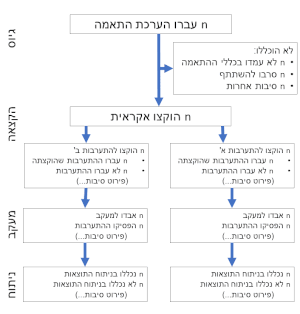
ניסוי מבוקר הקצאה אקראית (או ניסוי עם בקרת אקראיות,[2] RCT ) הוא סוג של ניסוי מדעי שמטרתו לבדוק השפעת בחירות שונות על תוצאות באופן סטטיסטי. RCT נעשה על ידי הקצאה אקראית של נבדקים לשתי קבוצות או יותר, ביצוע טיפול שונה בהן, ולאחר מכן מדידה והשוואת תוצאות בין הקבוצות.
הקצאה אקראית (רנדומיזציה) היא תהליך של הצבת נבדקי הניסוי בקבוצות טיפול או בקבוצות בקורת באמצעות שימוש במיקריות. ניסוי RCT בסיסי כולל שתי קבוצות בגודל דומה: קבוצת הניסוי - שבה נערכת ההתערבות, וקבוצת הביקורת - בה נערכת התערבות חלופית, כגון תרופת דמה (פלסבו) או אי-התערבות. הקבוצות עוברות תקופת מעקב בהתאם לתכנון מראש, כדי לבחון כיצד השפיעה ההתערבות הניסויית.[3] השפעת הטיפול מוערכת על ידי השוואת תוצאות קבוצת הניסוי לתוצאות קבוצת הביקורת. ניתן לערוך גם RCT עם יותר מקבוצת טיפול אחת או יותר מקבוצת ביקורת אחת.
יתרונו הגדול של ה-RCT הוא בצימצום הטיות. הקצאה אקראית לקבוצות גדולות מאזנת גורמים מנבאים (ערפלנים) ידועים ובלתי ידועים בין הקבוצות.[4] כך מתבטלת הטיית ההקצאה. כן מצטמצמות למינימום גם הטיות בחירה והטיות מידע האופייניות למחקרי עוקבה. כך, RCT מאפשר הוכחה או הפרכה של סיבתיות הסתברותית.
הניסוי עשוי להיות חד-סַמְיוּת, שבו הנבדקים לא יודעים לאיזו קבוצה הם הוקצו, או כפול סמיות, שבו לא הנבדקים ולא מְבַצְּעֵי הטיפול יודעים מהי הקצאת הנבדקים. סמיות מפחיתה צורות אחרות של הטיות - של הנבדק ושל הנסיין. הדבר נעשה על ידי שימוש בנהלים זהים ככל האפשר עם כל הנבדקים. כל הבדל חייב להיות מהותי לטיפולי ההשוואה (למשל, כאשר חוקרים טיפול קבוצתי לעומת טיפול אישי, ביקורי בית לעומת שיחות טלפון וכו').
RCT משמש בדרך כלל לבחינת התערבויות או טיפולים רפואיים חדשים או התוויות חדשות שלהם. RCT כפול סמיות נחשב תקן הזהב עבור ניסויים קליניים ובמיוחד בשלב III. הוא משמש לבחינת היעילות (השפעה נמדדת כלשהי), המועילות (השפעה על תסמינים או מחלות כלשהן), התועלת (השפעה בריאותית כוללת, לדוגמה, תמותה-מכל-סיבה) והבטיחות (סיכונים כגון תופעות לוואי של תרופות) של התערבויות רפואיות. הצהרת "ספיריט" SPIRIT 2013 מספקת המלצות מבוססות-ראיות לגבי התוכן המינימלי שדרוש לפרוטוקול ניסוי קליני ומשמשת כתקן בינלאומי מקובל.[5]
המונחים "ניסויים מבוקרים עם הקצאה אקראית" (RCT) ו"ניסויי הקצאה אקראית" (RT) משמשים לעיתים כמילים נרדפות, אך המונח האחרון משמיט אזכור של בקרה ולכן עשוי לתאר מחקרים המשווים קבוצות טיפול מרובות זו מול זו בהיעדר קבוצת ביקורת.[6] ויותר מכך, באנגלית, ראשי התיבות RCT מורחבות לעיתים לא כ"ניסוי קליני אקראי" אלא כ"ניסוי השוואתי (באנגלית: Comperative) אקראי", מה שמוביל לעמימות בספרות המדעית .[7][8] לא כל הניסויים הקליניים האקראיים הם ניסויים מבוקרים אקראיים (וחלקם אף פעם לא יכולים להיות, כמו במקרים שבהם הבקרות יהיו לא מעשיות או לא מוסריות לביצוע). המונח ניסוי קליני אקראי מבוקר הוא מונח חלופי המשמש במחקר קליני ;[9] עם זאת, RCT מתבצעים גם בתחומי מחקר אחרים, כולל רבים מתחומי מדעי החברה.
היסטוריה
הניסוי הקליני הראשון בוצע על ידי ג 'יימס לינד בשנת 1747 כדי למצוא טיפול לצפדינה.[10] ניסויים אקראיים הופיעו בפסיכולוגיה, שם הם הוצגו על ידי צ'ארלס סנדרס פירס וג'וזף יאסטרוב ב-1880,[11] ובחינוך.[12][13][14] בתחילת המאה ה-20, הופיעו גם ניסויי הצבה אקראית בחקלאות, על ידי יז'י ניימן[15] ורונלד א. פישר. מחקריו הניסויים של פישר וכתביו העלו את קרנם של ניסויי ההצבה האקראית.[16]
ב-1948 הופיע לראשונה RCT ברפואה כמאמר מדעי. כותרתו: "טיפול סטרפטומיצין בשחפת ריאתית" והוא תיאר מחקר של המועצה למחקר רפואי.[17][18][19] אחד מהמחברים של המאמר היה אוסטין ברדפורד היל, אשר נחשב כהוגה ה-RCT המודרני.[20]
עד סוף המאה ה-20, מחקרי RCT הוכרו כשיטה הסטנדרטית של "טיפולים רציונליים" ברפואה.[21] בשנת 2004, נכללו יותר מ 150,000 מחקרי RCT בספריית קוקרן .[20] כדי לשפר את הדיווח של מחקרי RCT בספרות הרפואית, קבוצה בינלאומית של מדענים ועורכים פרסמה את התקן המוסכם לדיווח על מחקרי רנדומיזציה (קונסורט) בשנת 1996, 2001 ו 2010, ואלה הפכו מקובלים.[22][23]
אתיקה
עקרון האיזון הקליני ("אי-ודאות אמיתית בקרב מומחי הקהילה הרפואית... לגבי הטיפול המועדף"), שהיה מקובל לגבי ניסויים קליניים[24], יושם ל-RCT. אך לאתיקה של RCT יש שיקולים מיוחדים. ראשית, נטען כי איזון קליני בלבד אינו מספיק להצדקת RCT.[25] שנית, 'איזון קולקטיבי' יכול להתנגש עם העדר 'איזון אישי' (למשל, אמונה אישית שהתערבות יעילה).[26] לבסוף, העיצוב של Zelen, אשר שימש בכמה מחקרי רנדומיזציה מבוקרים, מקצה באקראי נבדקים לפני שהם נותנים הסכמה מדעת, מה שאמנם עשוי להיות אתי עבור מחקרי RCT של סקירת מחלות וטיפולים מסוימים, אך לא ייחשב מוסרי עבור רוב הניסויים הטיפוליים.[27][28]
אף על פי שהנבדקים כמעט תמיד נותנים הסכמה מדעת להשתתפותם ב- RCT, מחקרים משנת 1982 הראו כי נבדקי RCT עשויים להאמין כי הם יקבלו את הטיפול הטוב ביותר עבורם באופן אישי; כלומר, הם לא מבינים את ההבדל בין מחקר וטיפול.[29][30] נדרשים מחקרים נוספים כדי לקבוע את השכיחות ואת הדרכים לטפל ב'תפיסה הטיפולית המוטעית'.[30]
בתהליך הגיוס של נבדקים עלול שימוש בהסברים או דוגמאות לא מאוזנות ואופטימיות לגרום להטעייה לגבי מהות המחקר והצפי.[31] לדוגמה, חולים עם מחלה סופנית עשויים להצטרף לניסויים בתקווה להירפא, גם כאשר הטיפולים אינם צפויים להצליח בכך.
רישום מחקרים
בשנת 2004, הוועדה הבינלאומית של עורכי הרפואה (ראשי תיבות באנגלית: ICMJE), שכללה את 12 כתבי העת היוקרתיים של הרפואה, הודיעה כי כל הניסויים המתחילים רישום של נבדקים לאחר 1 ביולי 2005 חייבים להיות רשומים מראש במאגר ציבורי על מנת שישקל פרסום של תוצאותיהם.[32] עם זאת, רישום מחקרים עשוי עדיין להתבצע מאוחר או בכלל לא.[33][34] כמו כן, כתבי עת רפואיים נמצאו איטיים בהתאמת מדיניות המחייבת רישום ניסוי קליני כתנאי חובה מוקדם לפרסום תוצאותיהם.[35]
סיווגים
על פי מתווה המחקר
דרך אחת לסווג מחקרי RCT היא על פי מתווה המחקר. מתווי מחקרי ה-RCT העיקריים בספרות הרפואית הם (מהנפוץ יותר לנפוץ פחות):[36]
- קבוצות מקבילות (באנגלית: Parallel) - כל נבדק מוקצה באופן אקראי לקבוצה, וכל הנבדקים בקבוצה מקבלים (או לא מקבלים) התערבות.
- מוצלב (באנגלית: Crossover) - לאורך תקופת המחקר, כל משתתף מקבל (או לא מקבל) התערבות, ברצף אקראי.[37][38]
- אשכול (באנגלית: Cluster) - קבוצות קיימות של משתתפים (למשל, כפרים, בתי ספר, מרפאות) נבחרות באופן אקראי לקבל (או לא לקבל) התערבות.
- פקטוריאל - כל משתתף מוקצה באופן אקראי לקבוצה המקבלת שילוב מסוים של התערבויות או אי-התערבויות (לדוגמה, קבוצה 1 מקבלת ויטמין X וויטמין Y, קבוצה 2 מקבלת ויטמין X ופלצבו Y, קבוצה 3 מקבלת פלצבו X וויטמין Y, וקבוצה 4 מקבלת פלצבו X ו- פלצבו Y).
ניתוח של 616 מחקרי RCT שנרשמו ב-PubMed במהלך חודש דצמבר 2006 מצא כי 78% היו ניסויים מקביליים (קבוצות מקבילות), 16% היו מוצלבים, 2% היו מפוצלי-גוף, 2% מחקרי אשכול ו-2% היו פקטריאליים.[36]
על פי התוצאה הנבחנת (חוללות לעומת תכליתיות, efficacy vs. effectiveness)
מחקרי RCT יכולים להיות מסווגים כ"מדגימים" או "פרגמטיים".[39] מחקרי RCT "מדגימים" (באנגלית: Explanatory) בוחנים את חוללות ההתערבות (באנגלית: Efficacy), כלומר השפעה בתנאי ניסוי מבוקרים מאוד ועם משתתפים שנבחרו בקפידה.[39] לעומתם מחקרי RCT "פרגמטיים" (pRCT) בוחנים אֵפֶקְטִיבִיות (באנגלית: Effectivity, תכליתיות) של הטיפול, על ידי בחירת משתתפים פחות קפדנית ובתנאים גמישים יותר. תנאים הדומים יותר לתנאי הפעילות הקלינית היומיומית. בדרך זו, מחקרי RCT פרגמטיים יכולים לתת מידע התומך בקבלת החלטות לגבי פעולה.[39]
על פי ההשערה (עליונות לעומת אי-נחיתות לעומת שקילות)
סיווג נוסף של מחקרי RCT מקטלג אותם כ "ניסויי עליונות" (באנגלית: superiority), "ניסויי אי-נחיתות" (באנגלית: noninferiority) ו"ניסויי שקילות" (באנגלית:equivalence) אשר נבדלים בשיטה (מתודולוגיה) ובדיווח.[40] רוב מחקרי ה-RCT הם ניסויי עליונות, שבהם, לפי ההשערה, התערבות אחת היא עדיפה על אחרת באופן משמעותי מבחינה סטטיסטית.[40] חלק ממחקרי ה-RCT הם ניסויי אי-נחיתות (באנגלית: noninferiority) "כדי לקבוע אם טיפול חדש אינו גרוע יותר מאשר הטיפול המושווה אליו."[40] מחקרי RCT אחרים הם ניסויי שקילות שבהם ההשערה היא כי שתי התערבויות אינן נבדלות זו מזו.[40]
אקראיות
היתרונות של הקצאה אקראית נאותה במחקרי RCT כוללים:[41]
- ביטול הטיה בהקצאת ההתערבות, במיוחד הטיה בבחירה ומשתנים מתערבים (ערפלנים) אחרים.
- הקלה על שמירת סמיות (מיסוך) של זהות-הטיפול מהחוקרים, מהמשתתפים ומבוחני-התוצאים.
- מאפשרת שימוש בתאוריית ההסתברות כדי לבטא את הסיכוי שהבדל בתוצאה בין קבוצות הטיפול הוא מיקרי.
בהקצאה אקראית נאותה של הנבדקים להתערבויות שונות יש לקבוע שני הליכים: הליך ההקצאה והליך הסתרת ההקצאה. הליך הקצאה אקראית מטרתו ליצור רצף בלתי צפוי של הקצאות; הליך זה עשוי להיות הקצאה אקראית פשוטה של נבדקים לכל קבוצה בהסתברות שווה או עשוי להיות "מוגבל" (restricted), או "מסתגל" (adaptive). הליך הסתרת ההקצאה, משמעותו אמצעי זהירות קפדניים שננקטים על מנת להבטיח שהקצאת הקבוצה של המטופלים לא תיחשף מוקדם מדי. הליכים "שיטתיים" לא אקראיים של הקצאה קבוצתית, כגון החלפת נבדקים בין קבוצה אחת לאחרת, יכולים לגרום ל"אפשרויות זיהום בלתי מוגבלות" ולהפרה של סמיות ההקצאה.[42]
עקב קושי באיתור עדויות אמפיריות לכך שהקצאה אקראית נאותה משפיעה על התוצאות (בהשואה להקצאה אקראית לקויה), יש הטוענים כי חשיבתה פחותה לעומת חשיבות הסמיות.[43]
נהלים
הקצאת הטיפול פירושה היחס הרצוי של הנבדקים בכל זרוע ניסוי.
הליך הקצאה אקראית אידיאלי הוא זה שישיג את המטרות הבאות:[44]
- מיקסום כוח סטטיסטי, במיוחד בניתוח תת-קבוצות. באופן כללי, גודלי קבוצה שווים מגדילים למקסימום את הכוח הסטטיסטי, עם זאת, קבוצות בגדלים לא שווים עשויות לשפר כוח סטטיסטי לניתוחים מסוימים (למשל, השוואות מרובות של פלצבו לעומת מינונים שונים באמצעות הפרוצדורה של דנט[45] ), ולעיתים הן רצויות מסיבות לא אנליטיות (למשל, כאשר מוטיבציה של חולים להירשם לניסוי תתחזק אם יש בו סיכוי גבוה יותר לקבל את טיפול הבדיקה, או כאשר סוכנויות רגולטוריות עשויות לדרוש מספר מינימלי של חולים שייחשף לטיפול).[46]
- מזעור בחירת הטיה. זו עלולה להתרחש אם החוקרים יכולים במודע או באופן לא מודע להעדיף רישום חולים לפי זרועות הטיפול. הליך אקראיות טוב יהיה בלתי צפוי, כך שהחוקרים לא יוכלו לנחש את הקצאת הקבוצה הבאה של הנבדק לפי הקצאת הנבדקים הקודמים. הסיכון של הטיה בבחירה הוא הגבוה ביותר כאשר הקצאות הטיפול הקודמות ידועות (כמו במחקרים ללא-סמיות) או ניתנות לניחוש (למשל אם לתרופה יש תופעות לוואי ייחודיות).
- מזעור הטיה בהקצאה (או ערפלן). זו עלולה להתרחש כאשר משתנים המשפיעים על התוצאה אינם נחלקים באופן שווה בין קבוצות הטיפול, והשפעת הטיפול מתערבבת עם ההשפעה של המשתנים (כלומר, "הטיה מקרית"[41][47]). אם הליך ההקצאה האקראית גורם לחוסר איזון במשתנים הקשורים לתוצאה בין קבוצות, אומדני ההשפעה עשויים להיות מוטים אלא אם יעברו התאמה למשתנים (אשר עשויים להיות לא מדודים ולכן לא ניתנים להתאמה כזו).
אין הליך הקצאה אקראית יחיד העונה על מטרות אלה בכל הנסיבות. לכן על החוקרים לבחור מהו ההליך הנאות ביותר למחקר נתון לפי היתרונות והחסרונות שלו.
הליך הקצאה פשוט
זהו הליך נפוץ ואינטואיטיבי, בדומה ל'זריקת מטבע חוזרת הוגנת',[41] הידוע גם בשם אקראיות מלאה או 'בלתי מוגבלת'. הוא חסין נגד הטיות הבחירה והמקריות. החיסרון העיקרי שלו הוא האפשרות של גודל קבוצות לא מאוזן במחקרי RCT קטנים (עם פחות מ-200 נבדקים).[48]
הליך הקצאה מוגבל
כדי לאזן גדלים קבוצתיים במחקרי RCT קטנים יותר, מומלץ ליצור צורה כלשהי של רנדומיזציה "מוגבלת".[48] הסוגים העיקריים של אקראיות מוגבלת הנמצאים בשימוש ב-RCT הם:
- הקצאה אקראית עם פרמוטציית בלוקים (באנגלית: permuted blocks) או אקראיות חסומה (באנגלית: blocked randomization): "גודל בלוק" ו"יחס הקצאה" (מספר נבדקים בקבוצה אחת לעומת הקבוצה האחרת) מוגדרים מראש, ונבדקים מוקצים באופן אקראי בתוך כל בלוק.[42] לדוגמה, גודל בלוק של 6 וקצב הקצאה של 2:1 יוביל להקצאה אקראית של 4 נבדקים לקבוצה אחת ו -2 לאחרת. סוג זה של אקראיות יכול להיות משולב עם "אקראיות מרובדת", למשל לפי אתר, במחקר רב אתרים (באנגלית: multicenter trial), כדי להבטיח איזון טוב של מאפייני המשתתפים בכל קבוצה.[4] מקרה מיוחד של הליך אקראיות חסומה ממוחשב הוא הקצאה אקראית שבה המדגם כולו מטופל כבלוק אחד.[42] החסרון העיקרי בהליך אקראיות חסומה הוא שגם אם גודלי הבלוקים גדולים ומגוונים באופן אקראי, ההליך עלול להוביל להטיית בחירה.[49] חסרון נוסף הוא כי ניתוח נאות של נתונים מ-RCT של אקראיות חסומה דורש ריבוד לפי בלוקים.[50]
- שיטות הקצאה אקראית מסתגלת של מטבע-מוטה (מהן הקצאה אקראית מהכד - באנגלית: urn randomization - היא הנפוצה ביותר): בשיטות לא נפוצות אלו, ההסתברות להיות מוקצה לקבוצה נעשית קטנה יותר אם הקבוצה מיוצגת יתר על המידה (וגם להפך, נעשית גדולה יותר אם הקבוצה אינה מיוצגת כראוי).[42] שיטות אלו נחשבות פחות מושפעות מהטיית הבחירה מאשר אקראיות חסומה.[50]
הקצאה מסתגלת
לפחות שני סוגי הליכי הקצאה אקראית "הסתגלותית" שימשו במחקרי RCT, אך הם נדירים בהשוואה להקצאה אקראית פשוטה או מוגבלת:
- הקצאה אקראית מסתגלת-למשתנים-נילוים (באנגלית: Covariate-adaptive randomization), מתוכם סוג אחד הוא מזעור (מינימיזציה; באנגלית: minimization): ההסתברות להיות מוקצה לקבוצה משתנה כך ש"חוסר איזון משתנים" יהיה מזערי.[50]
- הקצאה אקראית מסתגלת-לתגובה (באנגלית: Response-adaptive randomization), הידועה גם בשם הקצאה אקראית המסתגלת לתוצאות (באנגלית: outcome-adaptive randomization): ההסתברות להקצאה לקבוצה גדלה אם התגובות של החולים הקודמים בקבוצה היו רצויות.[50] נטען כי גישה זו היא אתית יותר מאשר סוגים אחרים של אקראיות כאשר ההסתברות כי טיפול יעיל (או לא יעיל) מתגבר במהלך RCT, אך הטענה טרם נבדקה היטב.[51]
הסתרת ההקצאה
הסתרת ההקצאה (באנגלית: Allocation concealment), מוגדרת כ'נוהל להגנה על תהליך ההצבה האקראית, כך שהטיפול המוקצה אינו ידוע לפני כניסת המטופל למחקר' והיא חשובה ב-RCT.[52] בפועל, חוקרים קליניים במחקרי RCT מתקשים לעיתים קרובות לשמור על חוסר משוא פנים. פורסמו בספרות המדעית דיווחים על חוקרים המביטים במעטפות סגורות מול אור חזק כדי לקרוא את תוכנן, או פורצים למשרד כדי לגלות את רשימת ההקצאות.[42] פרקטיקות אלה מביאות להטיות בחירה וערפלנים (כאשר שני אלה אמורים להיות ממוזערים על ידי הצבה אקראית), ומאפשרים עיוות של תוצאות המחקר.[42] הסתרה נאותה של ההקצאה צריכה למנוע מהמטופלים ומהחוקרים כל גילוי של הקצאת הטיפול מרגע תחילת הניסוי וגם לאחר סיומו. בנוסף, גם תופעות לוואי הקשורות לטיפול עשויות להיות ייחודיות מספיק כדי לחשוף את ההקצאה לחוקרים או למטופלים ובכך להביא להטיה או להשפיע על פרמטרים סובייקטיביים שנאספים.
חלק מהשיטות הסטנדרטיות להבטחת הסתרת ההקצאה כוללות מעטפות ממוספרות, אטומות, חתומות (באנגלית: Sequentially Numbered, Opaque, Sealed Envelopes - SNOSE); מיכלים ממוספרים ברצף; הצבה אקראית מבוקרת של תרופות; והצבה אקראית מרכזית.[42] מומלץ לכלול שיטות להסתרת ההקצאה בפרוטוקול של ה-RCT ולפרט אותן בפרסום תוצאות המחקר; עם זאת, מחקר שנערך בשנת 2005 קבע כי ברוב מחקרי ה-RCT, לא ברורה שיטת ההסתרה בפרוטוקול שלהם, בפרסומים שלהם, או בשניהם.[53] מאידך גיסא, מחקר שנערך ב-2008 לגבי 146 מטא-אנליזות, הגיע למסקנה כי תוצאות מחקרי RCT עם הסתרת הקצאה לא מספקת או לא ברורה נוטות להיות מוטות כלפי תוצאות טובות רק כשתוצאות ה-RCT היו סובייקטיביות ולא אובייקטיביות.[54]
גודל המדגם
מהימנות ה-RCT תלויה במספר 'יחידות הטיפול' (איברים, נבדקים או קבוצות נבדקים) שהוקצו לקבוצות הבקרה וההתערבות. גורם חשוב נוסף הוא 'השפעת הטיפול': מספר יחידות הטיפול הדרושות בשתי הקבוצות כדי לדחות את השערת האפס יוכל להיות קטן יותר כאשר השפעת הטיפול גדולה יותר. הכישלון בדחיית השערת האפס מרמז על כך שלטיפול אין השפעה מובהקת סטטיסטית על המטופלים במבחן נתון. מצד שני, ככל שגודל המדגם עולה, אותו RCT עשוי להיות מסוגל להדגים השפעה משמעותית של הטיפול, גם אם השפעה זו קטנה.[55]
סמיות
RCT יכול להיות עם סמיות, (מכונה גם "ממוסך" מלשון מסכה) על ידי נוהל המונע מהמשתתפים במחקר, מטפלים, או בוחני-תוצאה מלדעת איזו התערבות ניתנה.[54] שלא כמו הסתרה של הקצאה, סמיות היא לעיתים לא הולמת או אף בלתי אפשרית לביצוע ב RCT; לדוגמה, אם הטיפול ב-RCT דורש השתתפות פעילה של המטופל (למשל, פיזיותרפיה), לא ניתן ליצור סמיות של המשתתפים לגבי ההתערבות.
באופן מסורתי, מחקרי RCT סווגו כ"בעלי סמיות יחידה", "כפולי סמיות", או "משולשי סמיות"; עם זאת, בשנת 2001 ו 2006 מחקרים הראו כי למונחים אלה יש משמעויות שונות עבור אנשים שונים.[56][57] הצהרת קונסורט 2010 מציינת כי על מחברים ועורכים להימנע מלהשתמש במונחים אלו; במקום זאת, דיווחים של RCT עם סמיות צריך לדון "אם נעשה מיסוך, מי היה 'סומא' לאחר הקצאה התערבויות (למשל, המשתתפים, מספקי הטיפול, מעריכי התוצאות) וכיצד."[58]
מחקרי RCT ללא סמיות (באנגלית: unblinded)[59] נקראים גם "פתוחים",[60] או "של תווית פתוחה" (אם ההתערבות היא תרופה).[61] מחקר מ-2008 הדגים כי תוצאות סוביקטיביות של RCT ללא סמיות נטו להיות מוטות לטובת השפעת טיפול מיטיבה, אך לא כך לגבי תוצאות אובייקטיביות;[54] למשל, ב-RCT של טיפולים לטרשת נפוצה, נוירולוגים ללא סמיות הרגישו שהטיפולים מועילים, בניגוד לנוירולוגים 'סומים'.[62] במחקרי RCT פרגמטיים, אף על פי שהמשתתפים והמטפלים הם לעיתים קרובות ללא סמיות, "עדיין רצוי ולעיתים קרובות ניתן להשאיר סמיות אצל מעריכי התוצאה או להשיג מקור אובייקטיבי של נתונים להערכת התוצאות."[39]
ניתוח נתונים
סוגי השיטות הסטטיסטיות המשמשות במחקרי RCT תלויים במאפייני הנתונים וכוללים:
- עבור נתוני תוצאות דיכוטומיים (בינאריים), ניתן להשתמש במבחן כי בריבוע (למספר נבדקים גדול), במבחן המדויק של פישר או ברגרסיה לוגיסטית, וניתן להשתמש גם בשיטות אחרות.
- לנתוני תוצאות רציפות, ניתן להשתמש במבחן T (כאשר ההתפלגות נורמלית) או במבחנים א-פרמטריים דוגמת וילקוקסון ובניתוח של שונות (ANCOVA).
- עבור נתוני תוצאות של זמן-עד-לאירוע, שעשויות להיות מצונזרות, מתאימים ניתוחי הישרדות (לדוגמה, אומדני Kaplan-Meier ומודלים של יחסי סיכון על שם קוקס.
מעבר לשיטות הסטטיסטיות, שיקולים חשובים בניתוח נתוני RCT כוללים:
- האם יש להפסיק את ה-RCT מוקדם בשל תוצאות ביניים? לדוגמה, ניתן להפסיק RCT בשלב מוקדם, אם מתברר כי ההתערבות מייצרת תועלת או נזק גדול מהצפוי, או אם חוקרים מוצאים ראיות להיעדר הבדל חשוב בין התערבויות ניסוי לבקרה.[63]
- המידה שבה ניתן לנתח את הקבוצות בדיוק כפי שנוצרו בהקצאה האקראית (כלומר, אם נעשה שימוש ב'ניתוח לפי הכוונה לטפל' intention-to-treat analysis). ניתוח "טהור" כזה אפשרי רק כאשר זמינים נתוני תוצאות מלאים עבור כל הנבדקים שהוקצו;[64] כאשר חלק מנתוני התוצאות חסרים, אפשרויות הבחינה הסטטיסטית כוללות: ניתוח של מקרים עם תוצאות ידועות בלבד וניתוח תוך שימוש בנתונים משוערים.[65] עם זאת, ככל שהניתוחים יוכלו לכלול את סך המשתתפים בקבוצות שאליהם חולקו אקראית, ההטיה של ה-RCT תהיה פחותה.[65]
- האם לבצע ניתוח תת-קבוצות (באנגלית: subgroup analysis)? לעיתים קרובות, ניתוחים אלה אינם רצויים שכן השוואות מרובות עשויות להניב ממצאים חיוביים כוזבים שאי אפשר לאשר על ידי מחקרים אחרים.[65]
דיווח על תוצאות
הצהרת קונסורט CONSORT) 2010) היא מערך מינימלי, מבוסס ראיות, להמלצות על דיווחי RCT.[66] רשימת הקונסורט 2010 כוללת כ-25 פריטים (ביניהם רבים עם תת-פריטים), המתמקדים בניסויים של הקצאה אקראית יחידנית, עם שתי קבוצות במקביל, שהם הסוג השכיח ביותר של RCT.[67]
עבור עיצובי RCT אחרים, פורסמו "הרחבות קונסורט", למשל:
- הצהרת קונסורט 2010: הרחבה על ניסויי הקצאה אקראית של אשכולות.[68]
- הצהרת קונסורט 2010: התערבויות טיפוליות לא תרופתיות[69][70]
חשיבות יחסית ומחקרים תצפיתיים
שני מחקרים, שפורסמו בכתב העת לרפואה של ניו-אינגלנד (באנגלית: New England Journal of Medicine) בשנת 2000, מצאו כי מחקרים תצפיתיים ומחקרי RCT הפיקו תוצאות דומות.[71][72] מחבריהם הטילו ספק "באמונה כי אין להשתמש במחקרים תצפיתיים לצורך הגדרת טיפול רפואי מבוסס ראיות", וכי תוצאות המחקר הן "עדות ברמה הגבוהה ביותר".[71][72] עם זאת, מחקר שפורסם ב-2001 בכתב העת של האיגוד הרפואי האמריקאי (באנגלית: JAMA Journal of American Medical Association) קבע כי בין מחקרים תצפיתיים לבין מחקרי RCT "ישנם פערים לא מקריים, ושכיח מאוד למצוא ביניהם הבדלים בהערכת מידת ההשפעה של הטיפול".[73]
הועלו גם קווי טיעון אחרים כנגד תרומתם היחסית של מחקרי RCT לידע המדעי לעומת סוגי מחקר אחרים:
- אם מדרגים סוגי מחקר לפי הפוטנציאל שלהם לתגליות חדשות, אזי ראיות אנקדוטיות תהינה בראש הרשימה, אחריהן מחקרים תצפיתיים, ואחריהם RCT.[74]
- מחקרי RCT עשויים להיות מיותרים לבחינת טיפולים בעלי השפעות דרמטיות ומהירות ביחס למהלך הטבעי היציב או להידרדרות הצפויה.[75][76] דוגמה אחת היא כימותרפיה משולבת, כולל ציספלטין לסרטן אשכים גרורתי, שהגדיל את שיעור הריפוי מ -5% ל -60% במחקר לא אקראי.[76][77]
ככל השיטות הסטטיסטיות, גם מחקרי RCT עלולים ללקות בטעויות סטטיסטיות מסוג I ("חיובי כוזב") והן מסוג II ("שלילי כוזב") . לגבי שגיאות מסוג I, מחקר RCT טיפוסי ישתמש בערך p של 0.05 (כלומר, 1 ל-20) כהסתברות שיזהה שני טיפולים יעילים באותה מידה כאילו הם שונים באופן משמעותי.[78] באשר לשגיאות מסוג II, למרות פרסום של מאמר שפורסם ב-1978, שציין כי גודלי המדגם של מחקרי RCT רבים היו קטנים מכדי להסיק מסקנות ברורות לגבי התוצאות השליליות,[79] בשנים 2005–2006, שיעור לא מבוטל של דיווחי RCT עדיין כללו חישובי גודל מדגם לא מדויקים או חלקיים.[80]
ביקורת עמיתים
ביקורת עמיתים לגבי התוצאות היא חלק חשוב של השיטה המדעית. הסוקרים בוחנים את תוצאות המחקר לגבי בעיות אפשריות בתכנון העלולות להוביל לתוצאות לא מהימנות (למשל על ידי יצירת הטיה שיטתית). העמיתים מעריכים את המחקר ביחס למחקרים קשורים וראיות אחרות, ושוקלים אם ניתן לקבל את מסקנות המחקר כמהימנות ומגובות בראיות. כדי להדגים באופן היתולי את הצורך בבדיקת עמיתים ואת הסכנה של הכללת יתר, פרסמו שני חוקרים ניסוי מבוקר עם הקצאה אקראית של 23 מתנדבים, שבו קיבלו הנבדקים מצנח או תרמיל ריק והתבקשו לקפוץ ממטוס קל או מסוק. הם דיווחו, במדויק, כי מצנחים לא צמצמו את הפציעה בהשוואה לתרמילים ריקים. ההקשר המרכזי שהגביל את תחולתה הכללית של המסקנה הזאת היה שכלי הטיס חנו על הקרקע, ושהמשתתפים קפצו רק מגובה של כשני רגל.[81]
יתרונות
מחקרי RCT נחשבים לצורה האמינה ביותר של ראיות מדעיות בהיררכיה של הראיות המשפיעה על מדיניות הבריאות כיוון שהם מצמצמים סיבתיות-מזויפת והטיה. תוצאות RCT ניתן לשלב בסקירות שיטתיות אשר נמצאות יותר ויותר בשימוש כאמצעי להתערבות מבוססת ראיות. דוגמאות לחשיבות שמיחסים ארגונים מדעיים ל-RCT או לביקורות שיטתיות של מחקרי RCT כאיכות הגבוהה ביותר של ראיות יובאו להלן:
- החל ב -1998, המועצה הלאומית לבריאות ולחקר רפואי של אוסטרליה קבעה ראיות מסוג 'רמה I', כאלו ש"התקבלו מסקירה שיטתית של כל ניסוי ה-RCT הרלוונטיים" ו'רמה 2' כאלו ש"התקבלו מלפחות RCT אחד מתוכנן כהלכה".[82]
- מאז שנת 2001 לפחות, כוח המשימה של שירותי המניעה של ארצות הברית (ראשי תיבות באנגלית: USPSTF), המוציא המלצות לקביעת הנחיות קליניות, בחן הן את שיטת המחקר והן את תוקפו הפנימי, כסמנים לאיכותו.[83] הוא הכיר ב"ראיות המתקבלות מ-RCT נאות אחד לפחות", בעל תוקף פנימי טוב, כראיות האיכותיות ביותר העומדות לרשותו.[83]
- קבוצת העבודה של GRADE הסיקה בשנת 2008 כי "ניסויים מבוקרים עם הקצאה אקראית, שלא נמצאו בהם מגבלות מהותיות, מהווים ראיות איכותיות".[84]
- מרכז אוקספורד לרפואה מבוססת ראיות, בנושאים הקשורים ל-"טיפול / מניעה, סיבתיות / נזק", הגדיר לשנת 2011 ראיות של 'רמה 1a' כ"סקירה שיטתית של RCT המתאימים זה לזה", וכן ראיות 'רמה 1b' כ-RCT יחיד (עם מרווח ביטחון צר)."[85]
תוצאות מחקרי RCT מפתיעות וראויות לציון, כוללות:
- לאחר אישור מינהל המזון והתרופות, תרופות נגד הפרעות קצב לב בשם פלקאיניד (flecainide) ואנקאיניד (encainide) הגיעו לשוק בשנת 1986 ו-1987 בהתאמה.[86] המחקרים הלא האקראיים לגבי התרופות תוארו כ"הצלחה מזהירה",[87] ותפוצתן בתחילת 1989 הגיעה לכ-165,000 מרשמים לחודש.[86] אולם באותה שנה, דו"ח ראשוני של RCT סיכם כי שתי התרופות הגדילו את התמותה[88] והמכירות של התרופות ירדו.[86]
- לפני 2002, בהתבסס על מחקרים תצפיתיים, רופאים רשמו טיפול תחליף הורמונלי באופן שגרתי לנשים לאחר גיל המעבר כדי למנוע אוטם שריר הלב.[87] אך ב-2002 וב-2004, פרסומי RCT של ארגון הבריאות לנשים טענו כי נשים הנוטלות טיפול בתחליפי הורמונים עם אסטרוגן ופרוגסטין, היו בעלות שיעור גבוה יותר של אוטם שריר הלב מאשר נשים בקבוצת הפלצבו, וכי טיפול בתחליפי הורמון אסטרוגן בלבד לא גרם להפחתה השכיחות של מחלת לב כלילית.[89][90] הסברים אפשריים לפער בין המחקרים התצפיתיים ל-RCT הם בהבדלים במתודולוגיה, במשטרי ההורמונים בהם נעשה שימוש ובאוכלוסיות.[91][92] השימוש בתחליפי הורמונים פחת לאחר פרסום ה-RCT.[93]
קישורים חיצוניים
הערות שוליים
- ↑ K. F Schulz, D. G Altman, D. Moher, for the CONSORT Group, CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c332–c332 doi: 10.1136/bmj.c332
- ↑ "A method for assessing the quality of a randomized control trial". Controlled Clinical Trials. 2 (1): 31–49. 1981. doi:10.1016/0197-2456(81)90056-8. PMID 7261638.
- ↑ "Randomised controlled trial". National Institute for Health and Care Excellence, London, UK. 2019. נבדק ב-3 ביוני 2019.
{{cite web}}: (עזרה) - ^ 4.0 4.1 D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ An-Wen Chan, Jennifer M. Tetzlaff, Douglas G. Altman, Andreas Laupacis, SPIRIT 2013 Statement: Defining Standard Protocol Items for Clinical Trials, Annals of internal medicine 158, 2013-02-05, עמ' 200–207 doi: 10.7326/0003-4819-158-3-201302050-00583
- ↑ D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. I. Introduction and design". Br J Cancer. 34 (6): 585–612. 1976. doi:10.1038/bjc.1976.220. PMC 2025229. PMID 795448.
- ↑ "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. II. Analysis and examples". Br J Cancer. 35 (1): 1–39. 1977. doi:10.1038/bjc.1977.1. PMC 2025310. PMID 831755.
- ↑ "Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial". Lancet. 364 (9429): 141–8. 2004-07-10. doi:10.1016/S0140-6736(04)16626-9. PMID 15246726.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ↑ Dunn PM (בינואר 1997). "James Lind (1716-94) of Edinburgh and the treatment of scurvy". Arch. Dis. Child. Fetal Neonatal Ed. 76 (1): F64–5. doi:10.1136/fn.76.1.f64. PMC 1720613. PMID 9059193.
{{cite journal}}: (עזרה) - ↑ Charles Sanders Peirce and Joseph Jastrow (1885). "On Small Differences in Sensation". Memoirs of the National Academy of Sciences. 3: 73–83. http://psychclassics.yorku.ca/Peirce/small-diffs.htm
- ↑ Hacking, Ian (בספטמבר 1988). "Telepathy: Origins of Randomization in Experimental Design". Isis. A Special Issue on Artifact and Experiment. 79 (3): 427–451. doi:10.1086/354775. JSTOR 234674. MR 1013489.
{{cite journal}}: (עזרה) - ↑ Stephen M. Stigler (בנובמבר 1992). "A Historical View of Statistical Concepts in Psychology and Educational Research". American Journal of Education. 101 (1): 60–70. doi:10.1086/444032.
{{cite journal}}: (עזרה) - ↑ Trudy Dehue (בדצמבר 1997). "Deception, Efficiency, and Random Groups: Psychology and the Gradual Origination of the Random Group Design". Isis. 88 (4): 653–673. doi:10.1086/383850. PMID 9519574.
{{cite journal}}: (עזרה) - ↑ Neyman, Jerzy. 1923 [1990]. "On the Application of Probability Theory to AgriculturalExperiments. Essay on Principles. Section 9." Statistical Science 5 (4): 465–472. Trans. Dorota M. Dabrowska and Terence P. Speed.
- ↑ Denis Conniffe, R.A. Fisher and the development of statistics - a view in his centerary year, Journal of The Statistical and Social Inquiry Society of Ireland, 1991
- ↑ Br Med J, Streptomycin Treatment of Pulmonary Tuberculosis: A Medical Research Council Investigation, BMJ 2, 1948-10-30, עמ' 769–782 doi: 10.1136/bmj.2.4582.769
- ↑ Brown D (1998-11-02). "Landmark study made research resistant to bias". Washington Post.
- ↑ "Comparison of effects in randomized controlled trials with observational studies in digestive surgery". Ann Surg. 244 (5): 668–76. 2006. doi:10.1097/01.sla.0000225356.04304.bc. PMC 1856609. PMID 17060757.
- ^ 20.0 20.1 "Randomized controlled trials". Am J Roentgenol. 183 (6): 1539–44. 2004. doi:10.2214/ajr.183.6.01831539. PMID 15547188.
- ↑ Meldrum ML (2000). "A brief history of the randomized controlled trial. From oranges and lemons to the gold standard". Hematol Oncol Clin North Am. 14 (4): 745–60, vii. doi:10.1016/S0889-8588(05)70309-9. PMID 10949771.
- ↑ D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ K. F Schulz, D. G Altman, D. Moher, for the CONSORT Group, CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c332–c332 doi: 10.1136/bmj.c332
- ↑ Freedman B (1987). "Equipoise and the ethics of clinical research". N Engl J Med. 317 (3): 141–5. doi:10.1056/NEJM198707163170304. PMID 3600702.
- ↑ Gifford F (1995). "Community-equipoise and the ethics of randomized clinical trials". Bioethics. 9 (2): 127–48. doi:10.1111/j.1467-8519.1995.tb00306.x. PMID 11653056.
- ↑ "The ethics of randomised controlled trials from the perspectives of patients, the public, and healthcare professionals". Br Med J. 317 (7167): 1209–12. 1998. doi:10.1136/bmj.317.7167.1209. PMC 1114158. PMID 9794861.
- ↑ Zelen M (1979). "A new design for randomized clinical trials". N Engl J Med. 300 (22): 1242–5. doi:10.1056/NEJM197905313002203. PMID 431682.
- ↑ "What is Zelen's design?". Br Med J. 316 (7131): 606. 1998. doi:10.1136/bmj.316.7131.606. PMC 1112637. PMID 9518917.
- ↑ "The therapeutic misconception: informed consent in psychiatric research". Int J Law Psychiatry. 5 (3–4): 319–29. 1982. doi:10.1016/0160-2527(82)90026-7. PMID 6135666.
- ^ 30.0 30.1 "Clinical trials and medical care: defining the therapeutic misconception". PLoS Med. 4 (11): e324. 2007. doi:10.1371/journal.pmed.0040324. PMC 2082641. PMID 18044980.
- ↑ Jain SL (2010). "The mortality effect: counting the dead in the cancer trial". Public Culture. 21 (1): 89–117. doi:10.1215/08992363-2009-017.
- ↑ "Clinical trial registration: a statement from the International Committee of Medical Journal Editors". The New England Journal of Medicine. 351 (12): 1250–1. בספטמבר 2004. doi:10.1056/NEJMe048225. PMID 15356289.
{{cite journal}}: (עזרה) - ↑ "Despite law, fewer than one in eight completed studies of drugs and biologics are reported on time on ClinicalTrials.gov". Health Aff (Millwood). 30 (12): 2338–45. 2011. doi:10.1377/hlthaff.2011.0172. PMID 22147862.
- ↑ "Comparison of registered and published primary outcomes in randomized controlled trials". JAMA. 302 (9): 977–84. 2009. doi:10.1001/jama.2009.1242. PMID 19724045.
- ↑ Bhaumik, S (מרץ 2013). "Editorial policies of MEDLINE indexed Indian journals on clinical trial registration". Indian Pediatr. 50 (3): 339–40. doi:10.1007/s13312-013-0092-2. PMID 23680610.
{{cite journal}}: (עזרה) - ^ 36.0 36.1 "The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed". BMJ. 340: c723. 2010. doi:10.1136/bmj.c723. PMC 2844941. PMID 20332510.
- ↑ Jones, Byron; Kenward, Michael G. (2003). Design and Analysis of Cross-Over Trials (Second ed.). London: Chapman and Hall.
- ↑ Vonesh, Edward F.; Chinchilli, Vernon G. (1997). "Crossover Experiments". Linear and Nonlinear Models for the Analysis of Repeated Measurements. London: Chapman and Hall. pp. 111–202.
- ^ 39.0 39.1 39.2 39.3 Zwarenstein M, Treweek S, Gagnier JJ, Altman DG, Tunis S, Haynes B, Oxman AD, Moher D; CONSORT group; Pragmatic Trials in Healthcare (Practihc) group (2008). "Improving the reporting of pragmatic trials: an extension of the CONSORT statement". BMJ. 337: a2390. doi:10.1136/bmj.a2390. PMC 3266844. PMID 19001484.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ 40.0 40.1 40.2 40.3 Piaggio G, Elbourne DR, Altman DG, Pocock SJ, Evans SJ; CONSORT Group (2006). "Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement" (PDF). JAMA. 295 (10): 1152–60. doi:10.1001/jama.295.10.1152. PMID 16522836.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ 41.0 41.1 41.2 "Generation of allocation sequences in randomised trials: chance, not choice" (PDF). Lancet. 359 (9305): 515–9. 2002. doi:10.1016/S0140-6736(02)07683-3. PMID 11853818.
- ^ 42.0 42.1 42.2 42.3 42.4 42.5 42.6 "Allocation concealment in randomised trials: defending against deciphering" (PDF). Lancet. 359 (9306): 614–8. 2002. doi:10.1016/S0140-6736(02)07750-4. PMID 11867132.
- ↑ "In search of justification for the unpredictability paradox". Trials. 15: 480. 2014. doi:10.1186/1745-6215-15-480. PMC 4295227. PMID 25490908.
- ↑ John M. Lachin, Statistical properties of randomization in clinical trials, Controlled Clinical Trials 9, 1988-12-01, עמ' 289–311 doi: 10.1016/0197-2456(88)90045-1
- ↑ Rosenberger, James. "STAT 503 - Design of Experiments". Pennsylvania State University. אורכב מ-המקור ב-2013-06-12. נבדק ב-24 בספטמבר 2012.
{{cite web}}: (עזרה) - ↑ Avins, A L (1998). ""Can unequal be more fair? Ethics, subject allocation, and randomized clinical trials"". J Med Ethics. 24 (6): 401–408. doi:10.1136/jme.24.6.401. PMC 479141. PMID 9873981.
- ↑ Buyse ME (1989-12-01). "Analysis of clinical trial outcomes: some comments on subgroup analyses". Controlled Clinical Trials. 10 (4 Suppl): 187S–194S. doi:10.1016/0197-2456(89)90057-3. PMID 2605967.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ^ 48.0 48.1 John M. Lachin, John P. Matts, L. J. Wei, Randomization in clinical trials: Conclusions and recommendations, Controlled Clinical Trials 9, 1988-12-01, עמ' 365–374 doi: 10.1016/0197-2456(88)90049-9
- ↑ Lachin JM (1988-12-01). "Statistical properties of randomization in clinical trials". Controlled Clinical Trials. 9 (4): 289–311. doi:10.1016/0197-2456(88)90045-1. PMID 3060315.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ^ 50.0 50.1 50.2 50.3 John M. Lachin, John P. Matts, L. J. Wei, Randomization in clinical trials: Conclusions and recommendations, Controlled Clinical Trials 9, 1988-12-01, עמ' 365–374 doi: 10.1016/0197-2456(88)90049-9
- ↑ "The use of response-adaptive designs in clinical trials". Controlled Clinical Trials. 14 (6): 471–84. 1993. doi:10.1016/0197-2456(93)90028-C. PMID 8119063.
- ↑ "Allocation concealment and blinding: when ignorance is bliss". Med J Aust. 182 (2): 87–9. 2005. PMID 15651970.
- ↑ "Comparison of descriptions of allocation concealment in trial protocols and the published reports: cohort study". BMJ. 330 (7499): 1049. 2005. doi:10.1136/bmj.38414.422650.8F. PMC 557221. PMID 15817527.
- ^ 54.0 54.1 54.2 "Empirical evidence of bias in treatment effect estimates in controlled trials with different interventions and outcomes: meta-epidemiological study". BMJ. 336 (7644): 601–5. 2008. doi:10.1136/bmj.39465.451748.AD. PMC 2267990. PMID 18316340.
- ↑ Glennerster, Rachel; Kudzai Takavarasha (2013). Running randomized evaluations: a practical guide. Princeton: Princeton University Press. ISBN 9780691159249.
- ↑ "Physician interpretations and textbook definitions of blinding terminology in randomized controlled trials". J Am Med Assoc. 285 (15): 2000–3. 2001. doi:10.1001/jama.285.15.2000. PMID 11308438.
- ↑ "Who is blinded in randomized clinical trials? A study of 200 trials and a survey of authors". Clin Trials. 3 (4): 360–5. 2006. doi:10.1177/1740774506069153. PMID 17060210.
- ↑ D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ "The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial". Lancet. 369 (9566): 1016–26. 2007. doi:10.1016/S0140-6736(07)60461-9. PMC 2039891. PMID 17382828.
- ↑ "Oral versus intravenous antibiotics for community acquired lower respiratory tract infection in a general hospital: open, randomised controlled trial". BMJ. 310 (6991): 1360–2. 1995. doi:10.1136/bmj.310.6991.1360. PMC 2549744. PMID 7787537.
- ↑ Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, Amagai K, Hayashi S, Asaka M; Japan Gast Study Group (2008). "Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial". Lancet. 372 (9636): 392–7. doi:10.1016/S0140-6736(08)61159-9. PMID 18675689.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ "The impact of blinding on the results of a randomized, placebo-controlled multiple sclerosis clinical trial". Neurology. 44 (1): 16–20. 1994. doi:10.1212/wnl.44.1.16. PMID 8290055. אורכב מ-המקור ב-2005-05-10. נבדק ב-2019-06-12.
- ↑ D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ "What is meant by intention to treat analysis? Survey of published randomised controlled trials". Br Med J. 319 (7211): 670–4. 1999. doi:10.1136/bmj.319.7211.670. PMC 28218. PMID 10480822.
- ^ 65.0 65.1 65.2 D. Moher, S. Hopewell, K. F Schulz, V. Montori, CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials, BMJ 340, 2010-03-23, עמ' c869–c869 doi: 10.1136/bmj.c869
- ↑ CONSORT Group. "Welcome to the CONSORT statement Website". נבדק ב-2010-03-29.
- ↑ Schulz KF, Altman DG, ((Moher D; for the CONSORT Group)) (2010-03-23). "CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials". BMJ. 340: c332. doi:10.1136/bmj.c332. PMC 2844940. PMID 20332509.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) תחזוקה - ציטוט: multiple names: authors list (link) - ↑ "Consort 2010 statement: extension to cluster randomised trials". BMJ. 345 (e5661): e5661. 2012. doi:10.1136/bmj.e5661. PMID 22951546.
- ↑ "Extending the CONSORT Statement to randomized trials of nonpharmacologic treatment: explanation and elaboration". Annals of Internal Medicine. 148 (4): 295–309. 2008. doi:10.7326/0003-4819-148-4-200802190-00008. PMID 18283207.
- ↑ "Methods and Processes of the CONSORT Group: Example of an Extension for Trials Assessing Nonpharmacologic Treatments". Annals of Internal Medicine. 148 (4): W60–6. 2008. doi:10.7326/0003-4819-148-4-200802190-00008-w1. PMID 18283201.
- ^ 71.0 71.1 "A comparison of observational studies and randomized, controlled trials". N Engl J Med. 342 (25): 1878–86. 2000. doi:10.1056/NEJM200006223422506. PMID 10861324.
- ^ 72.0 72.1 "Randomized, controlled trials, observational studies, and the hierarchy of research designs". N Engl J Med. 342 (25): 1887–92. 2000. doi:10.1056/NEJM200006223422507. PMC 1557642. PMID 10861325. אורכב מ-המקור ב-2020-05-21. נבדק ב-2019-06-12.
- ↑ "Comparison of evidence of treatment effects in randomized and nonrandomized studies". J Am Med Assoc. 286 (7): 821–30. 2001. doi:10.1001/jama.286.7.821. PMID 11497536.
- ↑ Vandenbroucke JP (2008-03-11). "Observational research, randomised trials, and two views of medical science". PLoS Med. 5 (3): e67. doi:10.1371/journal.pmed.0050067. PMC 2265762. PMID 18336067.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ↑ Black N (1996). "Why we need observational studies to evaluate the effectiveness of health care". BMJ. 312 (7040): 1215–8. doi:10.1136/bmj.312.7040.1215. PMC 2350940. PMID 8634569.
- ^ 76.0 76.1 "When are randomised trials unnecessary? Picking signal from noise". Br Med J. 334 (7589): 349–51. 2007. doi:10.1136/bmj.39070.527986.68. PMC 1800999. PMID 17303884.
- ↑ Einhorn LH (2002). "Curing metastatic testicular cancer". Proc Natl Acad Sci U S A. 99 (7): 4592–5. doi:10.1073/pnas.072067999. PMC 123692. PMID 11904381.
- ↑ Wittes J (2002). "Sample size calculations for randomized controlled trials". Epidemiol Rev. 24 (1): 39–53. doi:10.1093/epirev/24.1.39. PMID 12119854.
- ↑ "The importance of beta, the type II error and sample size in the design and interpretation of the randomized control trial. Survey of 71 "negative" trials". N Engl J Med. 299 (13): 690–4. 1978. doi:10.1056/NEJM197809282991304. PMID 355881.
- ↑ "Reporting of sample size calculation in randomised controlled trials: review". Br Med J. 338: b1732. 2009-05-12. doi:10.1136/bmj.b1732. PMC 2680945. PMID 19435763.
- ↑ Richard Harris (22 דצמ' 2018). "Researchers Show Parachutes Don't Work, But There's A Catch".
{{cite news}}: (עזרה) - ↑ National Health and Medical Research Council (1998-11-16). A guide to the development, implementation and evaluation of clinical practice guidelines (PDF). Canberra: Commonwealth of Australia. p. 56. ISBN 978-1-86496-048-8. אורכב מ-המקור (PDF) ב-2009-10-14. נבדק ב-2010-03-28.
- ^ 83.0 83.1 Harris RP, Helfand M, Woolf SH, Lohr KN, Mulrow CD, Teutsch SM, Atkins D; Methods Work Group, Third US Preventive Services Task Force (2001). "Current methods of the US Preventive Services Task Force: a review of the process" (PDF). Am J Prev Med. 20 (3 Suppl): 21–35. doi:10.1016/S0749-3797(01)00261-6. PMID 11306229.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schünemann HJ; GRADE Working Group (2008). "What is "quality of evidence" and why is it important to clinicians?". BMJ. 336 (7651): 995–8. doi:10.1136/bmj.39490.551019.BE. PMC 2364804. PMID 18456631.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Oxford Centre for Evidence-based Medicine (2011-09-16). "Levels of evidence". אורכב מ-המקור ב-2020-06-12. נבדק ב-2012-02-15.
- ^ 86.0 86.1 86.2 "Impact of the Food and Drug Administration approval of flecainide and encainide on coronary artery disease mortality: putting "Deadly Medicine" to the test". Am J Cardiol. 79 (1): 43–7. 1997-01-01. doi:10.1016/S0002-9149(96)00673-X. PMID 9024734.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ^ 87.0 87.1 Rubin R (2006-10-16). "In medicine, evidence can be confusing - deluged with studies, doctors try to sort out what works, what doesn't". USA Today. נבדק ב-2010-03-22.
- ↑ Cardiac Arrhythmia Suppression Trial (CAST) Investigators (1989-08-10). "Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators". N Engl J Med. 321 (6): 406–12. doi:10.1056/NEJM198908103210629. PMID 2473403.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ↑ Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J; Writing Group for the Women's Health Initiative Investigators (2002-07-17). "Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial". J Am Med Assoc. 288 (3): 321–33. doi:10.1001/jama.288.3.321. PMID 12117397.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) תחזוקה - ציטוט: multiple names: authors list (link) - ↑ "Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial". JAMA. 291 (14): 1701–12. 2004-04-14. doi:10.1001/jama.291.14.1701. PMID 15082697.
{{cite journal}}: תחזוקה - ציטוט: date and year (link) - ↑ "Understanding the divergent data on postmenopausal hormone therapy". N Engl J Med. 348 (7): 645–50. 2003. doi:10.1056/NEJMsb022365. PMID 12584376.
- ↑ Vandenbroucke JP (2009). "The HRT controversy: observational studies and RCTs fall in line". Lancet. 373 (9671): 1233–5. doi:10.1016/S0140-6736(09)60708-X. PMID 19362661.
- ↑ "Changes in postmenopausal hormone replacement therapy use among women with high cardiovascular risk". Am J Public Health. 99 (12): 2184–7. 2009-10-15. doi:10.2105/AJPH.2009.159889. PMC 2775780. PMID 19833984.
{{cite journal}}: תחזוקה - ציטוט: date and year (link)
ניסוי מבוקר הקצאה אקראית33091526Q1436668


