חסינות הומורלית
חסינות הומורלית (באנגלית: Humoral immunity) היא חסינות שמתווכת על ידי מקרומולקולות, כולל נוגדנים מופרשים, חלבוני מערכת המשלים ופפטידים אנטימיקרוביאליים שבנוזל חוץ-תאי. חסינות הומורלית נקראת כך מכיוון שהיא כוללת חומרים הנמצאים בנוזלי הגוף (humors), בניגוד לחסינות תאית. חסינות הומורלית מכונה גם חסינות המתווכת על ידי נוגדנים (antibody-mediated immunity).
חקר המרכיבים המולקולריים והתאיים היוצרים את מערכת החיסון, כולל תפקודם ואינטראקציה ביניהם, הוא המדע המרכזי של האימונולוגיה. מערכת החיסון מחולקת למערכת חיסון מולדת פרימיטיבית ומערכת חיסון נרכשת או מסתגלת של בעלי חוליות, שכל אחת מהן מכילה אלמנטים חיסוניים הומורליים ותאיים.
חסינות הומורלית מתייחסת לייצור נוגדנים ולתהליכים החופפים הנלווים אליו, לרבות הפעלת תאי T מסייעים (Th2) וייצור ציטוקינים, יצירת מרכז נבט והחלפת איזוטיפים (סוגי נוגדנים), הבשלת זיקה (Affinity maturation - התהליך שבו תאי B המופעלים על ידי תאי T מייצרים נוגדנים בעלי זיקה מוגברת לאנטיגן במהלך תגובה חיסונית) ויצירת תאי B עם זיכרון. חסינות הומורלית מתייחסת גם לתפקודים המשפיעים של נוגדנים, הכוללים נטרול פתוגן ורעלן, הפעלה קלאסית של מערכת המשלים, קידום אופסונינים של פגוציטוזיס (אופסונינים הם חלבונים חוץ-תאיים שנקשרים לחומרים או לתאים וגורמים לפגוציטוזיס) וסילוק פתוגנים.[1]
היסטוריה
הרעיון של חסינות הומורלית פותח בהתבסס על ניתוח הפעילות האנטיבקטריאלית של מרכיבי הסרום. פיתוח התיאוריה ההומורלית מיוחס להנס בוכנר.[2] בשנת 1890, בוכנר תיאר אלכסינים (alexins) כ"חומרי הגנה" הקיימים בסרום הדם ובנוזלי גוף אחרים ומסוגלים להרוג מיקרואורגניזמים. אלכסינים, שהוגדרו מאוחר יותר כ"משלים" על ידי פאול ארליך, הוכחו כמרכיבים המסיסים של התגובה המולדת המובילה לשילוב של חסינות תאית וחסינות הומורלית. גילוי זה עזר לקשר בין התכונות של חסינות מולדת ונרכשת.[2]
בעקבות גילוי החיידקים הגורמים לדיפתריה וטטנוס ב-1888, פון הרינג ושיבסבורו הראו שהמחלה לא חייבת להיגרם על ידי מיקרואורגניזמים. הם גילו שתסנינים נטולי תאים הספיקו כדי לגרום למחלה. בשנת 1890 נעשה שימוש בתסנינים של דיפתריה, שלימים נקראו רעלני דיפתריה, לחיסון בעלי חיים בניסיון להדגים שנסיוב מחוסן מכיל נוגד רעלן שיכול לנטרל את פעילות הרעלן ולהעביר חסינות לבעלי חיים שאינם מחוסנים.[3] בשנת 1897, ארליך הראה שנוגדנים נוצרים נגד הרעלנים הצמחיים ריצין ואברין, ושיער שנוגדנים אלה אחראים לחסינות.[2] ארליך ופון ברינג המשיכו לפתח נוגדן לרעלן הדיפתריה, שהפך להצלחה הראשונה של אימונותרפיה מודרנית.[3] גילוי נוגדנים תואמים הפך לכלי מרכזי בסטנדרטיזציה של חיסון וזיהוי זיהומים מתמשכים.[3]
| חומר | פעילות | תגלית |
|---|---|---|
| אלקסין/ים/ משלימים | רכיבים מסיסים בסרום שמסוגלים להרוג מיקרואורגניזמים | בוכנר (1890), ארליך (1892) |
| נוגדי רעלים | חומרים בסרום שיכולים לנטרל את פעילות הרעלים, המאפשרים חיסון פסיבי | פון ברינג ושיבסבורו (1890) |
| בקטריוליזין | חומרים בסרום שעובדים עם חלבונים משלימים כדי לעורר תמוגה חיידקית | ריצ'רד פייפר (1895) |
| אגלוטינינים ופרסיפיטינים (סוג של נוגדנים) חיידקיים | חומרים בסרום המאגדים חיידקים ומזרזים רעלנים חיידקיים | פון גרובר ודורהאם (1896), קראוס (1897) |
| המוליזינים | חומרים בסרום שעובדים עם משלים לפירוק (Lysis) תאי דם אדומים | ז'ול בורדה (1899) |
| אופסונינים | חומרים בסרום שמצפים את הממברנה החיצונית של חומרים זרים ומגבירים את קצב הפגוציטוזיס על ידי מקרופאגים | רייט ודאגלס (1903)[4] |
| נוגדן | גילוי ראשוני (1900), השערת קישור אנטיגן-נוגדנים (1938), גילוי הייצור על ידי תאי B (1948), מבנה (1972), גנים של אימונוגלובולינים (1976) | ארליך[2] |
נוגדנים
אימונוגלובולינים הם גליקופרוטאין במשפחת העל של האימונוגלובולינים שמתפקדים כנוגדנים. המונחים נוגדן ואימונוגלובולין משמשים לעיתים קרובות לסירוגין. הם נמצאים בדם ובנוזלי הרקמה, כמו גם בהפרשות רבות. במבנה, הם חלבונים כדוריים גדולים בצורת Y. ליונקים יש חמישה סוגי נוגדנים: אימונוגלובולין A, אימונוגלובולין D, אימונוגלובולין E, אימונוגלובולין G ואימונוגלובולין M. כל מחלקה של אימונוגלובולינים שונה בתכונותיה הביולוגיות והתפתחה כדי להתמודד עם אנטיגנים שונים.[5] נוגדנים מסונתזים ומופרשים על ידי תאי פלזמה שמקורם בתאי B של מערכת החיסון.
נוגדן משמש את מערכת החיסון הנרכשת כדי לזהות ולנטרל עצמים זרים כמו חיידקים ווירוסים. כל נוגדן מזהה אנטיגן ספציפי ייחודי למטרה שלו. על ידי קשירת האנטיגנים הספציפיים שלהם, נוגדנים יכולים לגרום לאגלוטינציה (הצטברות) ולמשקעים של תוצרי נוגדן-אנטיגן, המשמשים לפגוציטוזיס על ידי מקרופאגים ותאים אחרים, לחסימת קולטנים ויראליים וליצירת תגובות חיסוניות אחרות, כגון מסלול המשלים.
עירוי דם לא תואם גורם לתגובת עירוי, המתווכת על ידי התגובה החיסונית ההומורלית. תגובה מסוג זה, הנקראת תגובה המוליטית חריפה, גורמת להרס מהיר (המוליזה) של תאי הדם האדומים של תורם הדם על ידי נוגדני המארח. הסיבה היא בדרך כלל טעות משרדית, כגון יחידת דם שגויה שניתנת למטופל הלא נכון. התסמינים הם חום וצמרמורות, לפעמים עם כאבי גב ושתן ורוד או אדום (המוגלובינוריה). הסיבוך העיקרי הוא שהמוגלובין המשתחרר על ידי הרס של כדוריות דם אדומות עלול לגרום לאי-ספיקת כליות חריפה.
ייצור נוגדנים
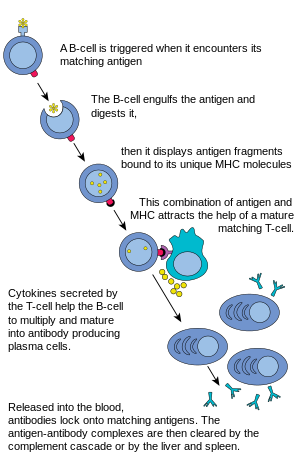
בתגובה חיסונית הומורלית, תאי B מבשילים לראשונה במח העצם ומקבלים קולטנים של תאי B (BCRs) המוצגים במספרים גדולים על פני התא.[6]
לקומפלקסים אלה של חלבונים הקשורים לממברנה יש נוגדנים שהם ספציפיים לזיהוי אנטיגן. לכל תא B יש נוגדן ייחודי הנקשר עם אנטיגן. לאחר מכן נודדים תאי B הבוגרים ממח העצם אל בלוטות הלימפה או איברים לימפתיים אחרים, שם הם מתחילים להיתקל בפתוגנים.

הפעלת תאי B
כאשר תא B נתקל באנטיגן, מופעל אות, האנטיגן נקשר לקולטן ונלקח לתוך תא B על ידי אנדוציטוזה. האנטיגן מעובד ומוצג שוב על פני השטח של תא B על ידי חלבוני MHC-II. חלבוני MHC-II מזוהים על ידי תאי T עוזרים, ממריצים את ייצור החלבונים, מאפשרים לתאי B להתרבות ולצאצאים להתמיין לתאים מפרישי נוגדנים המסתובבים בדם.[7] ניתן להפעיל תאי B באמצעות סוכנים מיקרוביאליים מסוימים ללא עזרתם של תאי T ויש להם יכולת לעבוד ישירות עם אנטיגנים כדי להגיב לפתוגנים.[7]
התפשטות תאי B
תא B ממתין לתא T עוזר (TH) שייקשר לקומפלקס. קישור זה יפעיל את תא ה-TH, וזה משחרר ציטוקינים הגורמים לתאי B להתחלק במהירות ויוצרים אלפי שיבוטים זהים של תא B. תאי בת אלה הופכים לתאי פלזמה או תאי זיכרון. תאי הזיכרון B נשארים לא פעילים; מאוחר יותר, כאשר ייתקלו באותו אנטיגן עקב הדבקה מחדש, יתחלקו וייצרו תאי פלזמה. תאי הפלזמה מייצרים נוגדנים רבים המשתחררים למחזור הדם.
תגובת נוגדן-אנטיגן
נוגדנים אלו יתקלו באנטיגנים וייקשרו איתם. זה יפריע לאינטראקציה הכימית בין תאים מארחים לתאים זרים, או שהם עלולים ליצור גשרים בין האתרים האנטיגנים שלהם ומפריעים לתפקודם התקין. נוכחותם עשויה גם למשוך מקרופאגים או תאים הורגים לתקוף אותם ולעשות להם פגוציטוזיס.
מערכת המשלים
מערכת המשלים היא מפל ביוכימי של מערכת החיסון המולדת המסייעת בניקוי פתוגנים מאורגניזם. המפל מופק מחלבוני פלזמה קטנים בדם הפועלים יחד כדי לשבש את קרום התא של תא המטרה המוביל לציטוליזה (Cytolysis) של התא. מערכת המשלים מורכבת מיותר מ-35 חלבונים מסיסים הקשורים לתאים, 12 מהם מעורבים ישירות במסלולי מערכת המשלים.[1] מערכת המשלים מעורבת בפעילויות של חסינות מולדת וחסינות נרכשת כאחד.
הפעלה של מערכת זו מובילה לציטוליזה, כימוטקסיס, אופסוניזציה, ניקוי חיסוני ודלקת, כמו גם לסימון פתוגנים לפגוציטוזה. החלבונים מהווים 5% מהחלק של הגלובולין בסרום. רוב החלבונים הללו מסתובבים כזימוגנים, שאינם פעילים עד לחישוף פרוטאוליטי (פרוטאוליזה, Proteolysis, היא פירוק חלבונים לפוליפפטידים קטנים יותר או חומצות אמינו).[1]
שלושה מסלולים ביוכימיים מפעילים את מערכת המשלים: מסלול המשלים הקלאסי, מסלול המשלים החלופי ומסלול הלקטין קושר מנוז. מסלול המשלים הקלאסי דורש בדרך כלל נוגדנים לצורך הפעלה והוא תגובה חיסונית ספציפית, בעוד שניתן להפעיל את המסלול החלופי ללא נוכחות של נוגדנים וזו תגובה חיסונית לא ספציפית.[8] נוגדנים, במיוחד מחלקת IgG1, יכולים גם "לתקן" משלים.
תהליכים אלו נבדלים רק בתהליך של הפעלת C3 convertase,[9] שהוא השלב הראשוני של הפעלת המשלים, והתהליך שלאחר מכן יוצר ממברנה מסוג שנקרא "מבנה התקפת ממברנה" (MAC) על דופן התא החיידקי כדי להשמיד את החיידקים.
ראו גם
- חסינות תאית (לעומת חסינות הומורלית)
- מערכת החיסון
- סרולוגיה
לקריאה נוספת
- המאמר הבא סוקר כמה מהניסויים המוקדמים שהניחו את היסודות של התיאוריה ההומורלית:
- Meltzer, S. J.; Norris, C. (1897). "The Bactericidal Action of Lymph Taken from the Thoracic Duct of the Dog". The Journal of Experimental Medicine. 2 (6): 701–709. doi:10.1084/jem.2.6.701. PMC 2117951. PMID 19866859. "פעולת קוטל החיידקים של הלימפה שנלקחה מצינור החזה של הכלב" . כתב העת לרפואה ניסיונית . 2 (6): 701–709. doi : 10.1084/jem.2.6.701 . PMC 2117951 . PMID 19866859 .
הערות שוליים
- ^ 1.0 1.1 1.2 Janeway CA Jr (2001). Immunobiology (5th ed.). Garland Publishing. ISBN 0-8153-3642-X.
- ^ 2.0 2.1 2.2 2.3 Metchnikoff, Elie (1905) Immunity in infectious disease (Full Text Version) Cambridge University Press
- ^ 3.0 3.1 3.2 3.3 Gherardi E. The experimental foundations of Immunology (אורכב 30.05.2011 בארכיון Wayback Machine) Immunology Course Medical School, University of Pavia.
- ↑ Hektoen, L. (1909). Opsonins and Other Antibodies. Science, 29(737), 241–248. http://www.jstor.org/stable/1634893
- ↑ Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 9781683672111.
- ↑ Boundless (2016-05-26). "Humoral Immune Response". Boundless (באנגלית). אורכב מ-המקור ב-2016-10-12. נבדק ב-2017-04-15.
- ^ 7.0 7.1 Charles A Janeway, Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J. (2001). "B-cell activation by armed helper T cells". Immunobiology: The Immune System in Health and Disease. 5th Edition (באנגלית).
- ↑ Janeway CA Jr (2001). Immunobiology (5th ed.). Garland Publishing. ISBN 0-8153-3642-X.
- ↑ Charles A Janeway, Jr; Travers, Paul; Walport, Mark; Shlomchik, Mark J. (21 בנובמבר 2001). "The complement system and innate immunity". Immunobiology: The Immune System in Health and Disease (5th ed.). New York: Garland Science – via www.ncbi.nlm.nih.gov.
{{cite book}}: (עזרה)
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
חסינות הומורלית37815793Q1142875


