נוקלאופיל
בכימיה, נוקלאופיל (בלטינית: אוהב גרעין) הוא מגיב היוצר קשר כימי עם השותף שלו לתגובה הכימית (האלקטרופיל) באמצעות תרומה של שני אלקטרוני קשר[1]. כיוון שנוקלאופילים תורמים אלקטרונים, הם מוגדרים כבסיסי לואיס. כל המולקולות או היונים עם זוג אלקטרונים חופשיים יכולים להתנהג כנוקלאופילים, למרות שאניונים נוטים לכך יותר מאשר מגיבים נייטרליים. תגובות נוקלאופיליות נייטרליות עם ממסים כגון כוהלים ומים נקראות סולבוליזיס.
נוקלאופילים עשויים ליטול חלק בהתמרה נוקלאופילית, שבה נוקלאופיל נמשך למטען חשמלי חיובי חלקי או מלא ביסוד כימי מסוים ומסלק את הקבוצה שאליה הוא נקשר.
נוקלאופילי הוא תואר המתאר הזיקה של נוקלאופיל לגרעין האטום, בעוד שנוקלאופיליות או חוזק נוקלאופילי מתייחסים לתכונת עצמה. ברוב המקרים עושים שימוש במונח נוקלאופיליות על מנת להשוות זיקה יחסית של אטום אחד לאטום אחר.
באופן כללי, ככל שהיון יותר בסיסי (כלומר, ככל שעולה ערך ה-pKa של החומצה המצומדת), כך גדלה עוצמת התגובה שלו כנוקלאופיל. הקוטביות חשובה גם כן לצורך קביעת הנוקלאופיליות: ככל שקל יותר להפריע לענן האלקטרונים מסביב לאטום או המולקולה, כך הנוקלאופיל יגיב יותר בקלות. לדוגמה: יון היודיד (−I) הוא יותר נוקלאופילי מאשר יון הפלואוריד (−F).
נוקלאופיל סביבתי הוא נוקלאופיל שיכול לתקוף משני מקומות או יותר, כך שיכולים להיווצר שניים או יותר תוצרים. לדוגמה, היון תיו-ציאנט (−SCN) עשוי לתקוף את אטום הגופרית או את אטום החנקן. מסיבה זו, התגובה SN2 של אלקיל הליד עם −SCN מובילה לרוב לתערובת של RSCN (אלקיל תיו-ציאנט) ו-RNCS (אלקיל איזו-תיו-ציאנט).
המונחים נוקלאופיל ואלקטרופיל הוצגו לראשונה על ידי כריסטופר קלק אינגולד ב-1929[2], והחליפו את המונחים קטיונואידי ואניונואידי שהוצעו לפני כן על ידי א.ג' לפוורת' ב-1925[3].
דוגמאות נפוצות
בדוגמאות שלהלן, החמצן של יון ההידרוקסיד תורם אלקטרון ונקשר לפחמן שבקצה מולקולת הברומו-פרופאן. הקשר בין הפחמן והברומין עובר ביקוע הטרוליטי, כאשר אטום הברומין קולט את זוג האלקטרונים והופך ליון ברומיד Br−:
להלן מספר דוגמאות לנוקלאופילים הכוללים יסודות שונים:
פחמן
נוקלאופילים עם פחמן הם אלקיל הלידים מתכתיים המעורבים בתגובת גריניאר, תגובת בלייז, תגובת רפורמצקי, ותגובת ברבייר, מגיבים מסוג אורגנו-ליתיום ואניונים של אלקין טרמינלי.
גם אנולים עונים להגדרה זאת. היצירה של אנול מזורזת על ידי חומצה או בסיס. אנולים הם נוקלאופילים סביבתיים, אולם, הם בדרך כלל תוקפים את פחמן אלפא (הפחמן הראשון במולקולה). השימוש הנפוץ בהם הוא בתגובות דחיסה, כולל דחיסת קלייזן וריאקציות דחיסת אלדול.
חמצן
דוגמאות לנוקלאופילים עם חמצן הן מים וכוהלים.
גופרית
נוקלאופילים עם גופרית הם תיולים (−HS).
דרגת הנוקלאופיליות של גופרית היא גבוהה מאוד. הסיבה לכך היא שאטום הגופרית גדול מאוד, מה שהופך אותו לנוח יותר לעבור קיטוב, וכן יש לו זוג אלקטרונים בודד (בחלק מהמקרים).
חנקן
נוקלאופילים עם חנקן הם אמוניה ואמינים.
מדד הנוקלאופיליות
עד היום, פותחו שיטות רבות בניסיון לכמת חוזק נוקלאופילי יחסי. המידע הניסויי שלהלן הושג על ידי מדידת קצבי תגובה במספר גדול ריאקציות המערבות מספר גדול של נוקלאופילים ואלקטרופילים ורגרסיה לינארית.
משוואת סוויין-סקוט
הניסיון הראשון מסוג זה נמצא במשוואת סוויין-סקוט[4][5] שפותחה ב-1953:
יחס האנרגיה החופשית הזה מקשר את קבוע קצב התגובה מסדר פסיאודו ראשון (במים ב-25°C), k, של התגובה, מנורמל לקצב התגובה, k, של תגובה סטנדרטית עם מים כנוקלאופיל, לקבוע הנוקלאופילי n עבור נוקלאופיל נתון וקבוע סובסטרט s שתלוי ברגישות של הסובסטרט להתקפה נוקלאופילית (מוגדר כ-1 עבור מתיל ברומיד).
טיפול זה נותן את הערכים הבאים עבור אניונים טיפוסיים: אצטט 2.7, כלוריד 3.0, אזיד 4.0, הידרוקסיד 4.2, אנילין 4.5, יודיד 5.0 ותיו-סולפט 6.4 . קבועי סובסטרט טיפוסיים הם 0.66 עבור אתיל תוזילאט, 0.77 עבור β-פרופיולקטון, 1.00 עבור 3-2-אפוקסי-פרופאנול, 0.87 עבור בנזיל כלוריד ו-1.43 עבור בנזואיל כלוריד.
המשוואה מנבאת שבהתמרה נוקלאופילית על בנזיל כלוריד, יון האזיד מגיב פי 3,000 יותר מהר מאשר מים.
משוואת ריצ'י
משוואת ריצ'י, הנקראת על שם יוצרה, פותחה ב-1972, והיא יחס אנרגיה חופשית נוסף[6][7][8]:
או
כאשר +N הוא הפרמטר שתלוי בנוקלאופיל ו-k0 הוא קבוע קצב התגובה של מים. במשוואה זו אין פרמטר תלוי סובסטרט כמו הפרמטר s במשוואת סוויין-סקוט. המשוואה מציינת ששני נוקלאופילים מגיבים עם אותה הֶגֶבִיוּת יחסית ללא קשר לטבעו של האלקטרופיל, מה שגורם להפרה של עקרון הגביות-סלקטיביות. מסיבה זו המשוואה נקראת גם יחס הסלקטיביות הקבוע.
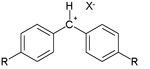
בפרסום הראשון המידע הושג מתגובה של נוקלאופילים נבחרים עם קרבוקטיונים אלקטרופיליים נבחרים כגון קטיוני טרופיליום:
או קטיוני דיאזוניום:
או (אינם מוצגים) יונים המבוססים על אנילין ירוק. במשך הזמן תוארו סוגים רבים של ריאקציות.
ערכי +N טיפוסיים (במתנול) הנובעים מהמשוואה הם: 0.5 עבור מתנול, 5.9 עבור האניון ציאניד, 7.5 עבור האניון מתוקסיד, 8.5 עבור האניון אזיד ו-10.7 עבור האניון תיו-פנול. הערכים עבור הגביות קטיון יחסית הם 0.4- עבור הקטיון אנילין ירוק, 2.6+ עבור הקטיון בנזן-דיאזוניום ו-4.5 עבור הקטיון טרופיליום.
משוואת מייר-פץ
k, קבוע קצב התגובה מסדר שני ב-20°C עבור תגובה מסוימת, קשור לפרמטר הנוקלאופיליות N, פרמטר אלקטרופיליות E ופרמטר השיפוע s התלוי בנוקלאופיל. הקבוע s מוגדר כ-1 במקרה של הנוקלאופיל 2-מתיל-1-פנטן. רוב הקבועים נגזרו מתגובה של יוני בנזהידריליום כאשר הם תפקדו כאלקטרופילים[10]:
ואוסף מגוון של נוקלאופילי- π:
ערכי E טיפוסיים הם 6.2 כאשר R הוא כלור, 5.9 עבור מימן, 0 עבור מתוקסי ו-7.02- עבור די-מתיל-אמין.
ערכי N טיפוסיים עם s בסוגריים הם 4.47- (1.32) עבור התמרה ארומטית אלקטרופילית לטולואן (1), 1.41- (1.12) עבור סיפוח אלקטרופילי ל-1-פניל-2-פרופן (2) ו-0.96 (1) עבור סיפוח ל-2-מתיל-1-פנטן (3), 0.13- (1.21) עבור תגובה עם טרי-פניל-אליל-סילאן (4), 3.61 (1.11) עבור תגובה עם 2-מתיל-פוראן (5), 7.48 (0.89 עבור תגובה עם איזו-בוטניל-טרי-בוטיל-סטאנאן (6) ו-13.36 (0.81) עבור תגובה עם אנאמין (7)[11].
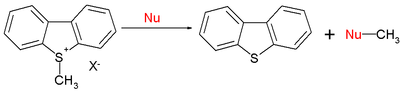
טווח הריאקציות האורגניות כולל גם ריאקציות SN2[12]:
כאשר E=-9.15 עבור היון S-מתיל-די-בנזנו-תיו-פניום, ערכי N נוקלאופיליים טיפוסיים (s) הם 15.63 (0.64) עבור פיפרידין, 10.49 (0.68) עבור מתוקסיד ו-5.20 (0.89) עבור מים. לסיכום,
הנוקלאופיליות לכיוון המרכז של אורביטל sp2 או sp3 מתאימה לאותה תבנית.
המשוואה המאוחדת
במאמץ לאחד את המשוואות שתוארו לעיל, משוואת מייר-פץ משוכתבת כך[12]:
כאשר sE הוא הפרמטר המשופע תלוי אלקטרופיליות ו- sN הוא הפרמטר המשופע שתלוי בנוקלאופיליות. ניתן לשכתב משוואה זו במספר דרכים:
- כאשר sE = 1 עבור קרבו-קטיונים, משוואה זו שקולה למשוואת מייר-פץ המקורית מ-1994.
- כאשר sN = 0.6 עבור רוב ה-n נוקלאופילים המשוואה נכתבת בצורה הבאה:
או משוואת סוויין-סקוט המקורית שנכתבת כך:
כאשר sE = 1 עבור קרבו-קטיונים וגם sN = 0.6 המשוואה משוכתבת כך:
או משוואת ריצ'י המקורית שנכתבת כך:
ראו גם
קישורים חיצוניים
| מיזמי קרן ויקימדיה |
|---|
הערות שוליים
- ^ Gold Book definition [1]
- ^ Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- ^ Lapworth, A. Nature (journal) 1925, 115, 625
- ^ Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides C. Gardner Swain, Carleton B. Scott J. Am. Chem. Soc.; 1953; 75(1); 141-147. Abstract
- ^ Gold Book definition [2]
- ^ Gold Book definition Link
- ^ Nucleophilic reactivities toward cations Calvin D. Ritchie Acc. Chem. Res.; 1972; 5(10); 348-354. Abstract
- ^ Cation-anion combination reactions. XIII. Correlation of the reactions of nucleophiles with esters Calvin D. Ritchie J. Am. Chem. Soc.; 1975; 97(5); 1170-1179. Abstract
- ^ Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions Angewandte Chemie International Edition in English Volume 33, Issue 9, Date: May 18, 1994, Pages: 938-957
- ^ Reference Scales for the Characterization of Cationic Electrophiles and Neutral NucleophilesHerbert Mayr, Thorsten Bug, Matthias F. Gotta, Nicole Hering, Bernhard Irrgang, Brigitte Janker, Bernhard Kempf, Robert Loos, Armin R. Ofial, Grigoriy Remennikov, and Holger Schimmel J. Am. Chem. Soc.; 2001; 123(39) pp 9500 - 9512; (Article)
- ^ An internet database for reactivity parameters maintained by the Mayr group is available at [3]
- ^ 12.0 12.1 Towards a General Scale of Nucleophilicity? Thanh Binh Phan, Martin Breugst, Herbert Mayr, Angewandte Chemie International Edition Volume 45, Issue 23, Pages 3869 - 3874 2006
| תגובות כימיות | |||||
|---|---|---|---|---|---|
| מיון תגובות | |||||
| על-פי מנגנון | |||||
| על-פי תרמודינמיקה |
| ||||
| מונחים | |||||
| קינטיקה של תגובות כימיות | תאוריית ההתנגשויות המולקולריות • אנרגיה חופשית • קבוע קצב • משוואת קצב • שלב קובע המהירות • אנרגיית שפעול • מצב מעבר • חומר ביניים • שיווי משקל כימי • טמפרטורה • לחץ • זרז | ||||
| נושאים נוספים | סטריאוכימיה • סטריאוסלקטיביות • סטריאוספציפיות • כיראליות • אפקט סטרי • היברידיזציה • קונפיגורציה מולקולרית • רזוננס כימי • היפרקוניוגציה • מערכת מצומדת • ארומטיות • כלל הופמן • כלל זייצב • כלל מרקובניקוב • כללי וודוורד-הופמן | ||||
| פורטל כימיה | |||||