Clostridium tetani
| |
| מיון מדעי | |
| ממלכה: | חיידקים אמיתיים |
| מערכה: | Firmicutes |
| מחלקה: | Clostridia |
| סדרה: | Clostridiales |
| משפחה: | Clostridiaceae |
| סוג: | Clostridium |
| מין: | Clostridium tetani |
| שם מדעי | |
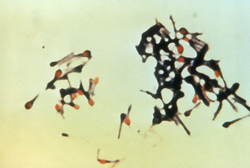
Clostridium tetani הוא חיידק אל-אווירני בצורת מתג מהסוג Clostridium. בדומה לחיידקים אחרים מסוג זה, הוא גראם חיובי, והמראה שלו בצביעת גראם דומה למוט של מחבט טניס או למקלות תופים[1]. C. tetani מתקיים בצורה נבגית בקרקע או כטפיל במערכת העיכול של בעלי חיים. C. tetani מייצר רעלן ביולוגי בשם טטנוספסמין, והוא הפתוגן שגורם למחלת הטטנוס.
היסטוריה
מחלת הטטנוס הייתה כבר בעת העתיקה, כאשר אנשים שחיו באותה תקופה זיהו את הקשר בין פצעים שונים לבין עוויתות שרירים קטלניות. ב-1884 ארתור ניקולייר בודד את הרעלן דמוי הסטריכנין של הטטנוס מחיידק אל-אווירני עצמאי. האטיולוגיה של המחלה הובהרה באופן נרחב יותר באותה שנה על ידי אנטוניו קרל וג'יורג'יו ראטונה, שהראו בפעם הראשונה שמחלת הטטנוס יכולה לעבור בין שני יצורים שונים. הם גרמו לטטנוס בארנבים באמצעות הזרקה של רקמת עצב שאליה הוסף חומר ממוגלה של אדם שנפגע בצורה קשה מטטנוס. ב-1889 C. tetani בודד מקורבן אנושי על ידי קיטסאטו שיבסבורו, שמאוחר יותר הראה שהאורגניזם שבודד מסוגל לגרום לטטנוס כאשר הוא מוזרק לבעלי חיים, ושניתן לנטרל את הרעלן באמצעות נוגדנים ייחודיים. ב-1897 אדמונד נוקארד הראה שהאנטי-רעלן של טטנוס משרה חיסון סביל בבני אדם, וניתן לעשות בו שימוש לטיפול במחלה ולמניעתה. החיסון הטוקסואידי של טטנוס פותח על ידי פ. דסקומבי ב-1924, ונעשה בו שימוש נרחב על מנת למנוע השראת טטנוס בפצועים במהלך מלחמת העולם השנייה[2].
מאפיינים
C. tetani הוא חיידק מקלוני אל-אווירני שנצבע באופן גראם-חיובי בתרביות תאים טריות; תרביות צעירות יכולות להיצבע גם בצורה גראם-שלילית[1]. במהלך מחזור התא, החיידק לא יכול לשרוד בנוכחות חמצן, הוא רגיש לטמפרטורה ויש לו שוטון שמספק לו יכולת תנועה מוגבלת. ככל שהחיידק מתבגר, הוא מפתח בקצה שלו נבג, שמעניק לו את מראהו האופייני. הנבגים של C. tetani קשיחים מאוד, ועמידים לחום ולרוב חומרי החיטוי[3]. הנבגים מופצים באופן נרחב באמצעות אדמות שעברו זיבול, וניתן למצוא אותם גם על עור האדם ובהרואין מזוהם[2].
רעילות
C. tetani חודר למארח שלו ברוב המקרים דרך העור, ואז הוא מתרבה ומייצר נבגים. ברגע שמתרחשת הדבקה, C. tetani מייצר שני אקסו-רעלנים, טטנוליזין וטטנוספסמין. אחד עשר זנים של C. tetani זוהו עד כה, והם נבדלים זה מזה בעיקר באנטיגנים השוטוניים וביכולתם לייצר טטנוספסמין. הגנים שמקודדים את חלבון הרעלן נמצאים בפלסמיד שנמצא בכל הזנים הרעילים, וכל הזנים הללו מייצרים רעלנים זהים[4].
התפקיד של טטנוספסמין בחיידק לא ברור, והסיבה שהחיידק מייצר אותו איננה ודאית. טטנוספסמין הוא רעלן עצבי והוא גורם למאפיינים הקליניים של טטנוס. רעלן הטטנוס נוצר בחיידק חי, ומשוחרר כאשר דופן התא של החיידק משתנה בצורה משמעותית, כמו שקורה בנביטת נבג או במהלך פליגה. דרושה רמת סף של יצירת נבגים ושל גדילת תא וגטטיבית כדי לייצר את הרעלן[4].
כאשר הוא מאופיין לפי משקל, טטנוספסמין הוא אחד הרעלנים הקטלניים ביותר שידועים כיום. המנה המזערית הקטלנית (LD – lethal dose) היא 2.5 ננוגרם לכל קילוגרם משקל גוף. לדוגמה, די ב-175 ננוגרם רעלן להריגת אדם שמשקלו 70 קילוגרם[2]. הרעלנים היחידים שקטלניים יותר לבני אדם הם רעלן הבוטולינום, שמיוצר על ידי החיידק Clostridium botulinum והאקסו-רעלן שמיוצר על ידי Corynebacterium diphtheriae, שהוא הגורם למחלת הדיפתריה.
טטנוספסמין הוא מטלופרוטאין המכיל אבץ, והוא דומה מבחינת המבנה לרעלן הבוטולינום, אולם ההשפעות של שני הרעלנים שונות מאוד. C. tetani מייצר את הטטנוספסמין כרעלן אב הבנוי מפוליפפטיד יחיד במשקל 150kD, שנחתך על ידי פרוטאז לשני מקטעים; מקטע A (שרשרת קלה במשקל 50kD) ומקטע B (שרשרת כבדה במשקל 100kD) שנשארים מחוברים באמצעות גשר דיסולפידי. ניתן להשרות את חיתוך רעלן האב למקטעים A ו-B באופן מלאכותי באמצעות שימוש בטריפסין[4].
פעילות הרעלן
טטנוספסמין מופץ בדם ובמערכת הלימפה של המארח. הרעלן פועל במספר אתרים בתוך מערכת העצבים המרכזית, כולל קצות עצבים היקפיים, חוט השדרה, והמוח, ובתוך מערכת העצבים הסימפתטית. הרעלן נספג לתוך האקסון ומועבר לאורך הצמתים הסינפטיות, עד שהוא מגיע למערכת העצבים המרכזית, שם הוא נצמד במהירות לגנגליוזידים בצמתים קדם-סינפטיות של קצות עצבים מוטוריים[2].
המאפיינים הקליניים של טטנוס נגרמים כאשר רעלן הטטנוס חוסם דחפים מעכבים, באמצעות התערבות בשחרור של נוירוטרנסמיטרים, כולל גליצין וחומצה גאמא אמינו בוטירית (GABA). דבר זה גורם להתכווצות שריר שלא נתקלת בהתנגדות ולעווית. ייתכן ויהיו הפרעות בפעילות החשמלית של המוח, וייתכן שגם מערכת העצבים האוטונומית תושפע. ככל הנראה טטנוספסמין מונע את השחרור של הנוירוטרנסמיטרים באמצעות חיתוך בררני של רכיב מסוים בבועיות הסינפטיות הנקרא סינפטוברבין II[4].
טיפול
כאשר מתרחשת ההדבקה הראשונית בטטנוס, הטיפול מתמקד בדרך כלל בבקרה על עוויתות השרירים, עצירת ייצור הרעלן, ונטרול השפעותיו. הטיפול כולל מתן גלובולין טטנוס חיסוני (TIG), שמורכב מנוגדנים שמעכבים את רעלן הטטנוס (ידועים גם כאנטיטוקסינים טטניים), באמצעות קשירה אל והסרת רעלן טטנוס חופשי מהגוף. קשירה של הרעלן לקצות העצבים היא כל הנראה בלתי הפיכה, וה-TIG לא מסוגל לנטרל רעלן קשור. ההחלמה של העצבים שנפגעו דורשת הצמחה מחדש של קצות אקסונים[4]. מינונים גדולים של תרופות אנטיביוטיות (כגון מטרונידזול או פניצילין G פנים-שרירי) ניתנים גם כן ברגע שיש חשד להדבקה בטטנוס, על מנת לעכב את ייצור הרעלן.
מניעה של טטנוס כוללת חיסון, וניקוי של הפציעה הראשונית. טיפול מניעתי יכול להשפיע, בצורה של חיסון טוקסואידי של טטנוס, שניתן עם או בלי חיסון סביל ב-TIG. מספר מועט של מקרי טטנוס התרחשו באנשים שהיו מחוסנים נגד טטנוס. חיסון דפ"ט (דיפתריה-פרטוסיס-טטנוס) בצפון אמריקה ניתן בגילאי 2, 4, 6, ו-15-18 חודשים, ובעקבותיו ניתנת הגברה של החיסון לפני הכניסה לבית הספר (4-6 שנים). משטר טיפול זה מספק הגנה נגד טטנוס למשך 10 שנים בקירוב, ובכל 10 שנים, כאשר מומלץ לקבל זריקת תגבור של חיסון הטטנוס[2].
מחלת הטטנוס לא יכולה לעבור בין שני בני אדם, והיא המחלה היחידה שניתן למנוע אותה באמצעות חיסון והיא איננה מדבקת. הדבקה ב-C. tetani לא גורמת להשראת זיכרון חיסוני נגד הטטנוס, ויש לתת את החיסון הסביל נגד הטטנוס ברגע שמצבו של החולה התייצב[2].
לקריאה נוספת
- מיקרוביולוגיה קלינית, מסת"ב 0-940780-49-6
קישורים חיצוניים
- Clostridium tetani, באתר ITIS (באנגלית)
- Clostridium tetani, באתר NCBI (באנגלית)
- Clostridium tetani, באתר האנציקלופדיה של החיים (באנגלית)
- Clostridium tetani, באתר GBIF (באנגלית)
הערות שוליים
- ^ 1.0 1.1 Ryan KJ; Ray CG, Sherris Medical Microbiology, 4th ed., McGraw Hill, 2004, מסת"ב 0-8385-8529-9
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 Atkinson W, Hamborsky J, McIntyre L, Wolfe S, Epidemiology and Prevention of Vaccine-Preventable Diseases (The Pink Book), 9th ed., Public Health Foundation, 2006, [1]
- ↑ Madigan M; Martinko J, Brock Biology of Microorganisms, 11th ed., Prentice Hall, 2005, מסת"ב 0-13-144329-1
- ^ 4.0 4.1 4.2 4.3 4.4 Todar, Ken (2005) Pathogenic Clostridia Ken Todar's Microbial World. University of Wisconsin - Madison
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] Clostridium tetani26890273


