גיסט
 | |
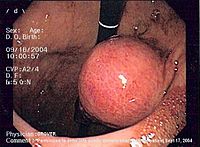
| תמונה היסטופתולוגית של גידול GIST בקיבה | |
| קישורים ומאגרי מידע | |
|---|---|
| DiseasesDB | 33849 |
| OMIM | 606764 |
| סיווגים | |
| ICD-O | M8936/0 - M8936/3 |
גידולי סטרומה במערכת העיכול (גידולי GIST; קיצור של Gastrointestinal stromal tumor) הם הגידולים המזנכימליים הנדירים ביותר במערכת העיכול, ומייצגים 1-3% מכלל הממאירויות של מערכת העיכול. הם מוגדרים לרוב כגידולים שהתנהגותם מוכתבת על ידי מוטציות בגן ל Kit או בגן ל PDGFRA, והם עשויים להדגים או לא להדגים צביעה חיובית ל-Kit.[1]
רקע
GIST הוכנס לשימוש כמונח דיאגנוסטי ב-1983.[2] עד שנות ה-90 המאוחרות של המאה ה-20, רבים מבין גידולי מערכת העיכול שלא ממקור אפיתליאלי כונו בשם "גידולי GIST". מומחי היסטופתולוגיה לא הצליחו להבחין באופן ספציפי בין סוגי הגידולים, אשר היום ידועים לנו כשונים מבחינה מולקולרית. לאחר מכן CD34, ומאוחר יותר CD117, זוהו כסמנים העשויים להבחין בין סוגי הגידולים השונים. בנוסף לכך, בהיעדר טיפול ספציפי, הסיווג הדיאגנוסטי היה בעל השפעה מוגבלת בלבד על פרוגנוזה וטיפול.

הבנת הביולוגיה של גידולי GIST השתנתה באופן משמעותי עם זיהוי הבסיס המולקולרי של GIST,[2] במיוחד זיהויו של c-KIT. מבחינה היסטורית, סקירות הספרות שפורסמו טרם ההגדרה הביולוגית של GIST, ובמשך זמן קצר לאחר מכן, טענו כי 70-80% מגידולי GIST הם שפירים. זיהוי הבסיס המולקולרי של GIST הוביל לשלילת רבים מהגידולים שנחשבו בעבר כ-GIST, וכן להכללת מספר גדול יותר באופן משמעותי של גידולים אשר סווגו כסוגים אחרים של גידולי סרקומה וקרצינומה בלתי ממוינת.[2] לדוגמה, חלק מהאבחנות הקודמות של גידולי ליומיוסרקומה (גידול ממאיר של שריר חלק) בקיבה ובמעי הדק ניתנים לסיווג מחדש כ- GIST על סמך צביעה אימונוהיסטוכימית. כיום כל גידולי GIST נחשבים כגידולים בעלי פוטנציאל ממאיר, ואף גידול GIST אינו יכול להיות מסווג כשפיר באופן חד משמעי.[3] לפיכך, כל גידולי GIST מתאימים לקביעת שלב הסרטן לפי AJCC (מהדורה 7)/ UICC.[4] עם זאת, גידולי GIST שונים דורשים הערכות סיכון שונות לגבי נטייתם להישנות או לשליחת גרורות, בהתאם למיקום המקורי, גודל ומספר המיטוזות. המידע הידוע כיום אודות מסלולי הטיפול הקליני טרם שנת 2000 הוא דל ביותר.
פתופיזיולוגיה
גידולי GIST הם גידולים של רקמת חיבור, דהיינו גידולי סרקומה; בניגוד למרבית גידולי מערכת העיכול, הם אינם ממקור אפיתליאלי. כ-70% מהגידולים מתפתחים בקיבה, 20% - במעי הדק ופחות מ-10% - בוושט. גידולים קטנים הם בדרך כלל שפירים, במיוחד כאשר קצב חלוקת התאים הוא איטי, אך גידולים גדולים מתפשטים לכבד, לאומנטום ולחלל הצפק. במקרים נדירים הם מתפתחים באברי בטן אחרים. הסברה היא כי גידולי GIST מתפתחים מתאים אינטרסטיציאליים ע"ש Cajal (interstitial cells of Cajal - ICC), שהם חלק ממערכת העצבים האוטונומית של המעי. תאים אלה הם בעלי תפקיד של קוצב בבקרת תנועת המעיים.
מוטציות ב-c-Kit
כ- 85% מגידולי GIST כרוכים בליקוי במסלול c-kit. c-kit הוא גן המקודד לקולטן טרנס-ממברנלי (חוצה את קרום התא) לגורם גדילה המכונה stem cell factor (SCF). הליקוי במסלול c-kit נובע במרבית המקרים (85%) ממוטציה בגן עצמו; גידולים המשתייכים לתת-קבוצה קטנה יותר של גידולי GIST הקשורים ל- c-kit כרוכים באקטיבציה קונסטיטוטיבית של המסלול האנזימטי KIT, אשר מתגלה באמצעות immunobloting.[2] התוצר של c-kit/ 117CD מתבטא על תאי ICC ועל תאים רבים אחרים, בעיקר תאי מח העצם, תאי פיטום (mast), מונוציטים ומספר תאים אחרים. עם זאת, במערכת העיכול, צביעה חיובית מסיבית ל-117CD מעידה בסבירות גבוהה על GIST שמקורו בתאי ICC. מולקולת c-kit כוללת מקטע חוץ-תאי ארוך, מקטע טרנס-ממברנלי וחלק תוך- תאי. המוטציות מתרחשות ככלל באזור ה-DNA המקודד לחלק התוך-תאי (אקסון 11), אשר פועל כטירוזין קינאז (tyrosine kinase) המפעיל אנזימים אחרים. המוטציות גורמות לכך שהתפקוד של c-kit הופך לבלתי תלוי בשפעול על ידי SCF, דבר המוביל לקצב חלוקת תאים גבוה ולאי-יציבות גנומית אפשרית. ככל הנראה דרושות מוטציות נוספות על מנת לגרום לתא עם מוטציה ב- c-kit להתפתח ל- GIST, אך המוטציה ב- c-kit היא כנראה השלב הראשון בתהליך זה. ידוע כי בגידולי GIST מתרחשות מוטציות באקסונים 11, 9 ובמקרים נדירים באקסונים 13 ו- 17 של הגן ל- c-kit. תפקודו של c-kit כטירוזין קינאז הוא חשוב לטיפול הרפואי בגידולי GIST, כמתואר להלן.
- KIT-D816V - מוטציות נקודתיות באקסון 17 של הגן ל- c-kit אחראיות לעמידות לתרופות מכוונות מטרה כגון imatinib mesylate, מעכב טירוזין קינאז.
- KIT-p.D419del (אקסון 8) – תת-קבוצה של גידולי GIST אשר בעבר נחשבו כגידולי זן בר (wild-type), הנושאים מוטציות משפעלות באקסון 8 של KIT (p.D419del).[5]
מוטציות ב- PDGFRA
מרבית תאי GIST עם c-kit מסוג זן בר (ללא מוטציות) נושאים במקום זאת מוטציה בגן אחר, PDGFR-α (platelet derived growth factor receptor alpha), שהוא טירוזין קינאז דומה. מוטציות ב- c-kit וב- PDGFrA שוללות זו את זו (דהיינו, המוטציה תתגלה באחד משני הגנים בלבד). [4,5]
גידולי זן בר
גידולי GIST מעטים יותר אינם כרוכים במוטציות ב- c-kit או ב-PDGFR-α .[2] כ- 10-15% מגידולי GIST נושאים רצפים תקינים בכל הנקודות החמות של KIT ו- PDGFRA.[5]
אפידמיולוגיה
גידולי GIST מתפתחים ב-10–20 למיליון בני אדם. השכיחות האמיתית עשויה להיות גבוהה יותר, מאחר ששיטות מעבדה חדשניות הן רגישות הרבה יותר באבחון גידולי GIST. השכיחות המשוערת של GIST בארצות הברית היא כ-5000 מקרים מדי שנה.[2] שכיחות זו הופכת את GIST לצורה הנפוצה ביותר של סרקומה, המכסה למעלה מ-70 סוגי סרטן. מרבית גידולי GIST מתגלים בגילאי 50–70 שנה. במרבית קבוצות הגיל, שכיחותם של גידולי GIST דומה בין גברים לנשים[6]. גידולי GIST במבוגרים מתחת לגיל 40 הם נדירים. גידולי GIST בילדים נחשבים כקבוצה ביולוגית נפרדת.[7] בניגוד לגידולי GIST בגילאים אחרים, גידולי GIST בילדים הם שכיחים יותר בקרב ילדות ונשים צעירות. נראה כי בגידולים אלה אין מוטציות אונקוגניות המשפעלות טירוזין קינאז ב- KIT וב- PDGFRA.[8] גידולי GIST בילדים מטופלים באופן השונה מאופן הטיפול במבוגרים. אף על פי שההגדרה המקובלת של גידול GIST בילדים היא גידול המאובחן בגיל 18 שנים ומטה,[7] גידולים מסוג "גידולי GIST בילדים" עשויים להתגלות במבוגרים, דבר המשפיע על הערכת הסיכון, חשיבותה של כריתת בלוטות הלימפה ובחירת הטיפול[9].
נטייה תורשתית
מרבית גידולי GIST הם ספורדיים. פחות מ-5% מהם מתפתחים כתסמונות רב- גידוליות משפחתיות תורשתיות או אידיופטיות. תסמונות אלו כוללות, לפי שכיחות בסדר יורד, נוירופיברומטוזיס ע"ש Recklinghausen (NF-1), טריאדה ע"ש Carney (GIST בקיבה, כונדרומה ריאתית ופארה-גנגליומה מחוץ לבלוטות אדרנל), מוטציות המגבירות את התפקוד של c-kit/ PDGFRA בתאי הנבט ותסמונת על שם Carney-Stratakis. תסמונת ע"ש Carney- Stratakis היא דיאדה של GIST תורשתי ופארה-גנגליומה, אשר נגרמת על ידי מוטציות תאי הנבט במסלול של גן מדכא גידול מיטוכונדריאלי המערב את תת-היחידות של succinate dehydrogenase SDHD, SDHC ו-SDHB[10] טריאדה ע"ש Carney אינה כרוכה במוטציות SDH[10].
אבחנה ותסמינים
גידולי GIST עלולים לגרום לקשיי בליעה, לדימום במערכת העיכול או לגרורות (בעיקר בכבד). חסימת מעיים היא נדירה לאור דפוס הצמיחה כלפי חוץ של הגידול. לעיתים תכופות קיימת היסטוריה של כאב בטן עמום או אי נוחות בבטן, והגידול מגיע לממדים גדולים למדי במועד האבחנה. האבחנה הוודאית מבוססת על ביופסיה, אשר יכולה להתבצע באופן אנדוסקופי, מלעורי לצד הנחיית CT או אולטרסאונד, או במהלך ניתוח. דגימת הביופסיה תיבדק מתחת למיקרוסקופ על ידי רופא פתולוג. הפתולוג בוחן את ההיסטופתולוגיה על מנת לזהות את מאפייני GIST (תאי כישור (spindle cells) ב-70-80%, היבט אפיתלואידי ב-20-30%). גידולים קטנים יותר עשויים להיות מוגבלים לשכבת השריר (muscularis propria) של דופן המעי. הגידולים הגדולים צומחים בעיקר כלפי חוץ מדופן המעי, עד אשר הם חוסמים את אספקת הדם שלהם ועוברים נמק (מתים), תוך יצירת חלל העשוי בסופו של דבר להתחבר עם חלל המעי. כאשר קיים חשד לGIST – בניגוד לסיבות אחרות לגידולים דומים – הפתולוג יכול להשתמש באימונוהיסטוכימיה (נוגדנים ספציפיים הצובעים את המולקולה 117CD [הידועה גם כ- c-kit). 95% מכלל גידולי GIST הם חיוביים ל-117CD (סמנים אפשריים נוספים כוללים 34CD, 1-DOG, דסמין ווימנטין). תאים אחרים המראים צביעה חיובית ל-117CD הם תאי פיטום. אם הצביעה ל-117CD היא שלילית ונותר חשד לכך כי הגידול הוא GIST, ניתן להשתמש בנוגדן החדש יותר 1-DOG (התגלה ב-1-GIST). כמו כן, ניתן להשתמש בריצוף הגנים ל- Kit ו- PDGFRA להוכחת האבחנה.
רדיולוגיה
מטרת הדימות הרדיולוגי היא לאתר את הנגע, להעריך אותו לסימני חדירה ולגלות גרורות. מאפייני GIST משתנים בהתאם לגודל הגידול ואבר המוצא. הקוטר עשוי לנוע ממספר מילימטרים עד יותר מ-30 ס"מ. גידולים גדולים יותר בדרך כלל גורמים לתסמינים בניגוד לאלה המתגלים באופן מקרי, אשר נוטים להיות קטנים יותר וקשורים בפרוגנוזה טובה יותר. גידולים גדולים נוטים להדגים התנהגות ממאירה, אך גידולי GIST קטנים עלולים אף הם להדגים התנהגות אגרסיבית מבחינה קלינית[11].

גידולי GIST קטנים: מאחר שגידולי GIST מתפתחים משכבת השריר של המעי (שהיא עמוקה יותר מהשכבה הרירית והתת-רירית ממבט לומינלי (מתוך החלל)), הדמיה של גידול GIST קטן מעידה לרוב על תהליך תת-רירי או גוש בתוך דופן המעי. בבדיקות בליעת בריום, גידולי GIST אלה בדרך כלל מדגימים גבולות חלקים היוצרים זווית ישרה או קהה עם דופן המעי הסמוכה, כפי שמודגם על ידי כל גוש תוך דופני. שטח פני הרירית הוא בדרך כלל שמור, למעט אזורי התכייבות, המתגלים ב-50% מגידולי GIST. אזורי התכייבות מתמלאים בבריום, תוך יצירת מראה המזכיר עין של שור או נגע מטרה. בסריקת CT עם חומר ניגוד, גידולי GIST קטנים נראים כגושים תוך-דופניים חלקים ומוגדרים היטב עם טשטוש הומוגני. גידולי GIST גדולים: ככל שהגידול גדל, הוא עשוי לבלוט מחוץ למעי (צמיחה אקזופיטית) ו/או לתוך המעי (צמיחה לתוך החלל), אך במרביתם נצפית צמיחה אקזופיטית, כך שחלקו הגדול של הגידול בולט לתוך חלל הבטן. אם הגידול חוסם את אספקת הדם שלו, הוא עשוי לעבור נמק פנימי תוך יצירת חלל מרכזי המתמלא בנוזל עם דימום וקוויטציות (חללי אדים), אשר בסופו של דבר מתכייבות ומתחברות לחלל המעי. במקרה זה, בליעת בריום עשויה להראות אוויר, פלסי אוויר-נוזל או הצטברות של חומר ניגוד באזורים אלה. כמו כן, התכייבויות ריריות עשויות להיות נוכחות. בהדמיות CT עם חומר ניגוד, גידולי GIST גדולים נראים כגושים הטרוגניים בשל אזורים של תאי גידול חיים סביב אזורי דמם, נמק או ציסטות, ומבחינה רדיוגרפית מתקבל דפוס של האדרה היקפית עם מרכז טשטוש נמוך.[12] בבדיקות MRI, מידת הנמק והדמם משפיעה על דפוס עוצמת הסיגנל. אזורי דמם בתוך הגידול ישנו את עוצמת הסיגנל בהתאם למשך הדימום. בדרך כלל החלקים המוצקים של הגידול מראים עוצמת סיגנל נמוכה בהדמיות משוקללות ב-1T ועוצמת סיגנל גבוהה בהדמיות משוקללות ב-2T, ו עוברים האדרה לאחר מתן גדוליניום. חללים בעוצמת הסיגנל נצפים כאשר קיים גז בתוך אזורי גידול נמקי.[13]
מאפייני ממאירות
ממאירות מתאפיינת בחדירה מקומית ושליחת גרורות, בדרך כלל לכבד, לאומנטום ולצפק. עם זאת, נצפו מקרים של גרורות לעצמות, לפלאורה, לריאות ולרטרופריטונאום. בניגוד לאדנוקרצינומה בקיבה או לימפומה בקיבה/ במעי הדק, הגדלה ממאירה של בלוטות הלימפה אינה שכיחה (< 10%), ובדיקות הדימות מראות לרוב היעדר של הגדלת בלוטות לימפה.[12] בהיעדר גרורות, מאפיינים רדיולוגיים אחרים המעידים על ממאירות כוללים: גודל (> 5 ס"מ), האדרה הטרוגנית לאחר מתן חומר ניגוד והתכייבויות. כמו כן, התנהגות ממאירה גלויה (בניגוד לפוטנציאל לממאירות מדרגה נמוכה יותר) נצפית בשכיחות נמוכה יותר בגידולי קיבה, כאשר היחס בין התנהגות שפירה לממאירות גלויה הוא 3-5:1.[14] אף בנוכחות מאפייני ממאירות רדיוגרפיים, ממצאים אלה עשויים לייצג גידולים אחרים, והאבחנה החד-משמעית חייבת להיות מבוססת על אימונוהיסטוכימיה.
דימות
צילום פשוט אינו מסייע באופן משמעותי בהערכת גידולי GIST. אם נצפה ממצא חריג, יהיה זה סמן עקיף בשל אפקט מסה של הגידול על איברים סמוכים. בצילום בטן, גידול GIST בקיבה עשוי להופיע כגוש אטום לקרינה המשנה את צורת הצל של אוויר הקיבה. גידולי GIST במעיים עשויים להסיט את לולאות המעי וגידולים גדולים יותר עלולים לחסום את המעי, והצילומים יראו דפוס חסימתי. בנוכחות קוויטציות, צילום פשוט יראה הצטברויות אוויר בתוך הגידול.[15] הסתיידות היא מאפיין חריג של GIST, אך אם היא קיימת, ניתן להבחין בה בצילומים פשוטים. בדיקות בריום פלואורוסקופית וסריקות CT נמצאות בשימוש נפוץ להערכת חולה עם תלונות בטניות. צילומי בליעת בריום מראים ממצאים חריגים ב-80% ממקרי GIST.[11]עם זאת, חלק מגידולי GIST עשויים להיות ממוקמים מחוץ לחלל המעי לחלוטין, ולא יתגלו באמצעות בליעת בריום. אף במקרים בהם התוצאות של בליעת בריום הן חריגות, חובה לבצע סריקת MRI או CT מאחר שאין אפשרות להעריך את חלל הבטן ואברי בטן אחרים באמצעות בליעת בריום בלבד. בסריקת CT, ייתכן כי יתגלו ממצאים חריגים ב-87% מהחולים, והן חייבות להתבצע עם חומר ניגוד פומי ותוך-ורידי כאחד.[11] מבין שיטות הדימות, סריקת MRI מציעה את ניגוד הרקמה הטוב ביותר, דבר המסייע בזיהוי גושים בתוך מערכת העיכול (גושים תוך-דופניים). חומר ניגוד תוך-ורידי נדרש להערכת הווסקולריות של הנגע. שיטות דימות מועדפות להערכת גידולי GIST הן CT ו- MRI[13], ובמצבים נבחרים, אולטרסאונד אנדוסקופי. יתרונות סריקת ה- CT כוללים את יכולתה להדגים עדות לחדירה לאברים סמוכים, מיימת וגרורות. יכולתה של סריקת MRI ליצור תמונות במספר מישורים מסייעת בזיהוי המעי כאבר המוצא (דבר הכרוך בקושי בגידולים גדולים מאוד), תוך קידום האבחנה.
ניתוח גידול גיסט
במקרה של גידולי GIST ממוקמים הניתנים לכריתה, אם הדבר ישים מבחינה אנטומית ופיזיולוגית, ניתוח הוא טיפול הבחירה העיקרי.[16] ניתוח עשוי להוביל לריפוי באופן פוטנציאלי, אך במקרים של גידולים קטנים, במצבים הנבחרים בקפידה, ניתן לשקול המתנה זהירה.[17] ייתכן כי יומלץ על טיפול משלים (אדג'ובנטי) לאחר הניתוח .[18] גרורות לבלוטות לימפה הן נדירות, והסרה שגרתית של בלוטות הלימפה אינה הכרחית לרוב. ניתוח לפרוסקופי, ניתוח בטן זעיר פולשני, תוך שימוש בטלסקופים וכלים מיוחדים, הוכח כיעיל בהסרת גידולים אלה ללא צורך בחתכים גדולים.[19] הסוגיות הקליניות המתייחסות להתוויות כירורגיות מדויקות לפי גודל הגידול עדיין שנויות במחלוקת. ההחלטה לגבי ניתוח לפרוסקופי מתאים מושפעת על ידי גודל הגידול, מיקומו ודפוס הצמיחה[20] מבחינה היסטורית, טיפול קרינה לא היה יעיל בטיפול בגידולי GIST וגידולי GIST אינם מגיבים למרבית התרופות הכימותרפיות,[6] עם שיעורי תגובה מתחת ל-5%.[2] עם זאת, שלוש תרופות זוהו כתרופות המעניקות תועלת קלינית בטיפול ב- GIST: אימטיניב (imatinib), סוניטיניב (sunitinib) ורגורפניב (regorafenib).
טיפול תרופתי בגידול גיסט
אימטיניב
(Glivec/Gleevec), תרופה פומית, אשר שווקה תחילה לטיפול בלוקמיה מיאלוגנית כרונית (CML) בהסתמך על עיכוב של bcr-abl, מעכבת טירוזין קינאז c-kit עם מוטציות ו-PDGFRA עם מוטציות שונות מלבד D842V; היא שימושית בטיפול בגידולי GIST במספר מצבים: במסגרת טיפול נאו-אדג'ובנטי במצבים נבחרים[16] במסגרת הטיפול האדג'ובנטי, מרבית גידולי GIST ניתנים לריפוי על ידי ניתוח, ואינם דורשים טיפול אדג'ובנטי[21] עם זאת, אחוז נכבד מגידולי GIST כרוך בסיכון גבוה להישנות כפי שהוערך על ידי מספר סכימות תקפות לסיווג הסיכון, וניתן לשקול טיפול אדג'ובנטי עבור גידולים מסוימים. הקריטריונים התומכים בקבלת ההחלטה בדבר שימוש אפשרי באימטיניב במצבים אלה כוללים הערכת סיכון על סמך גורמים פתולוגיים כגון גודל הגידול, הקצב המיטוטי ומיקום הגידול, זאת על מנת לנבא את הסיכון להישנות בחולי GIST. גידולים הקטנים מ-2 ס"מ עם קצב מיטוטי של <5/50 HPF הדגימו סיכון נמוך יותר להישנות לעומת גידולים גדולים יותר ואגרסיביים יותר. לאחר כריתה כירורגית של גידול GIST, טיפול משלים באימטיניב מפחית את הסיכון להישנות המחלה בקבוצות סיכון גבוה יותר. במצבים נבחרים של סיכון גבוה יותר המצדיקים טיפול משלים, מומלץ מתן אימטיניב במשך 3 שנים.[22]
אימטיניב אושר לטיפול ב- GIST גרורתי ובלתי ניתן לכריתה על ידי ה-FDA האמריקאי ב-1 בפברואר 2002. שיעור ההישרדות לשנתיים בקרב חולים עם מחלה מתקדמת עלה ל-75-80% בעקבות הטיפול באימטיניב[23]. במקרה של עמידות לאימטיניב, ניתן לשקול מתן סוניטיניב, מעכב של אנזימי טירוזין קינאז מרובים (משווק כ- Sutent)[24].
יעילותם של אימטיניב וסוניטיניב תלויה בגנוטיפ[25]. גידולי GIST ללא מוטציות ב- cKIT ו-PDGFRA הם בדרך כלל עמידים לטיפול באימטיניב[10] בדומה ל-GIST זן בר הקשור בנוירופיברומטוזיס 1. גידול הנושא תת-סוג ספציפי של מוטציה ב- PDGFRA, D842V, אף הוא אינו רגיש לאימטיניב.
סטיוורגה
סטיוורגה (רגורפניב) היא תרופה אונקולוגית המאושרת ורשומה לטיפול בגיסט[26]. זוהי תרופה ביולוגית שפוגעת באופן ממוקד ביכולתם של התאים הסרטניים להתרבות ולשגשג. סטיוורגה ניטלת בבליעה, וכלולה בסל הבריאות להתוויה של טיפול בסרטן GIST.
מנגנון הפעולה של סטיברגה:
- דיכוי ההתחלקות הבלתי נשלטת של תאי הגידול (פרופליפרציה)
- דיכוי צמיחת כלי הדם החדשים שמזינים את הגידול
- דיכוי סיגנלים במיקרו-סביבה של הגידול
סטיוורגה היא התרופה הראשונה שהצליחה להראות במחקר קליני גדול הארכת הישרדות ללא התקדמות מחלה של חולי GIST שמיצו את כל קווי הטיפול המקובלים. התרופה הוכיחה הארכת משך הזמן ללא התקדמות מחלה (progression-free survival) בחולי GIST[27] שמחלתם התקדמה לאחר מיצוי כל קווי הטיפול המקובלים.
במחקר קליני בשם GRID שנערך ב-199 חולים אשר טופלו ברגורפניב, הושגה האטה בצמיחת הגידול (הישרדות ללא התקדמות המחלה) ותוצאותיו פורסמו . התרופה אושרה במסגרת המסלול המהיר וזכתה לעדיפות מה-FDA בסרטן גיסט גרורתי או בלתי נתיח. ב-2015 קיבלה התרופה את אישור מנהל המזון והתרופות האמריקאי (FDA) להתוויה זו[28] ובישראל את אישור משרד הבריאות להתוויה זו. מ-2016 סטיברגה ניתנת לחולי GIST במסגרת סל התרופות.
קישורים חיצוניים
הערות שוליים
- ↑ Miettinen M, Lasota J (2006). "Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis". Arch Pathol Lab Med. 130 (10): 1466–78. doi:10.1043/1543-2165(2006)130[1466:GSTROM]2.0.CO;2. PMID 17090188.
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 Demetri, G., chapter author; DeVita, L; Lawrence, TS; Rosenberg, SA.; editors (2011). "Chapter 87". DeVita, Hellman, and Rosenberg's Cancer: Principles and Practice of Oncology (9th ed.). ISBN 978-1-4511-0545-2.
{{cite book}}:|first=has generic name (עזרה) - ↑ פרק זה לוקה בחסר. אנא תרמו למכלול והשלימו אותו.
- ↑ AJCC manual
- ^ 5.0 5.1 Huss, S; Künstlinger, H; Wardelmann, E; Kleine, M. A; Binot, E; Merkelbach-Bruse, S; Rüdiger, T; Mittler, J; Hartmann, W; Büttner, R; Schildhaus, H. U. (2013). "A subset of gastrointestinal stromal tumors previously regarded as wild-type tumors carries somatic activating mutations in KIT exon 8 (p.D419del)". Modern Pathology. 26 (7):1004-12. doi:10.1038/modpathol.2013.47.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ 6.0 6.1 Kantarjian, HM; Wolff, RA; Koller, CA. (2011). The MD Anderson Manual of Medical Oncology (2nd ed.). McGraw-Hill. ISBN 978-0-07-170106-8.
- ^ 7.0 7.1 Pappo AS, Janeway KA (פבר' 2009). "Pediatric gastrointestinal stromal tumors". Hematol Oncol Clin North Am. 23(1): 15–34. doi:10.1016/j.hoc.2008.11.005. PMID 19248968.
{{cite journal}}: (עזרה) - ↑ Kelly L, Bryan K, Kim SY, Janeway KA, Killian JK, Schildhaus HU, Miettinen M, Helman L, Meltzer PS, van de Rijn M, Debiec-Rychter M, O'Sullivan M. (2013). "Post-Transcriptional Dysregulation by miRNAs Is Implicated in the Pathogenesis of Gastrointestinal Stromal Tumor [GIST]". PLoS ONE. 8 (5): e64102. doi:10.1371/journal.pone.0064102.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Rege TA, Wagner AJ, Corless CL, Heinrich MC, Hornick JL (אפר' 2011). ""Pediatric-type" gastrointestinal stromal tumors in adults: distinctive histology predicts genotype and clinical behavior". Am J Surg Pathol. 35(4): 495–504. doi:10.1097/PAS.0b013e31820e5f7d.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ^ 10.0 10.1 10.2 Stratakis CA, Carney JA. The triad of paragangliomas, gastric stromal tumours and pulmonary chondromas (Carney triad), and the dyad of paragangliomas and gastric stromal sarcomas (Carney-Stratakis syndrome): molecular genetics and clinical implications. J Intern Med. 2009;266(1):43. PMID 19522824
- ^ 11.0 11.1 11.2 Pidhorecky I, Cheney RT, Kraybill WG, Gibbs JF (2000). "Gastrointestinal stromal tumors: current diagnosis, biologic behavior, and management". Ann Surg Oncol. 7 (9): 705–12. doi:10.1007/s10434-000-0705-6. PMID 11034250.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ 12.0 12.1 Hersh MR, Choi J, Garrett C, Clark R. (2005). "Imaging Gastrointestinal Stromal Tumors". Cancer Control. 12 (2): 111–115. PMID 15855894.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ 13.0 13.1 Tervahartiala P, Halavaara J. (1998). "Radiology of GIST. Gastrointestinal stromal tumours". Ann Chir Gynaecol. 87 (4): 291–2. PMID 9891768.
- ↑ Burkill GJ, Badran M, Al-Muderis O, Meirion Thomas J, Judson IR, Fisher C, Moskovic EC. (2003). "Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread". Radiology. 226 (2): 527–32. doi:10.1148/radiol.2262011880. PMID 12563150.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Shojaku H, Futatsuya R, Seto H; et al. (1997). "Malignant gastrointestinal stromal tumor of the small intestine: radiologic-pathologic correlation". Radiat Med. 15 (3): 189–92. PMID 9278378.
{{cite journal}}: Explicit use of et al. in:|author=(עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ^ 16.0 16.1 NCCN Clinical Practice Guidelines in Oncology Soft Tissue Sarcomas, version 3.2012. National Comprehensive Cancer Network.[1]
- ↑ Casali PG, Blay J-Y, on behalf of the ESMO/CONTICANET/EUROBONET (2010). "Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 21 (suppl 5): v98–v102. doi:10.1093/annonc/mdq208.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link)[2] - ↑ Bamboat ZM (2012). "Updates on the management of gastrointestinal stromal tumors". Surg Oncol Clin N Am. 21 (2): 301–16. doi:10.1016/j.soc.2011.12.004. PMID 22365521.
- ↑ Nguyen SQ, Divino CM, Wang JL, Dikman SH (במאי 2006). "Laparoscopic management of gastrointestinal stromal tumors". Surg Endosc. 20 (5): 713–6. doi:10.1007/s00464-005-0435-8. PMID 16502196.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Lee, Chung-Ho; Hyun, Myung-Han; Kwon, Ye-Ji; Cho, Sung-Il; Park, Sung-Soo. "Deciding Laparoscopic Approaches for Wedge Resection in Gastric Submucosal Tumors: A Suggestive Flow Chart Using Three Major Determinants". Journal of the American College of Surgeons. doi:10.1016/j.jamcollsurg.2012.07.009.
- ↑ פרק זה לוקה בחסר. אנא תרמו למכלול והשלימו אותו.
- ↑ Cohen MH, Johnson JR, Justice R, Pazdur R (2012). "Approval summary: imatinib mesylate for one or three years in the adjuvant treatment of gastrointestinal stromal tumors. U.S. Food and Drug Administration, Silver Spring, MD 20993-0002, USA". Oncologist. 17(7): 992–997. doi:10.1634/theoncologist.2012-0109. PMID 22643537.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ פרק זה לוקה בחסר. אנא תרמו למכלול והשלימו אותו.
- ↑ Reichardt P, Blay, J-Y, Boukovinas, I; et al. (2012). "Adjuvant therapy in primary GIST: state-of-the-art". Annals of Oncology. 23(11): 2776–2781. doi:10.1093/annonc/mds198.
{{cite journal}}: Explicit use of et al. in:|author=(עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ↑ "News: Genetic Variations in GI Tumors Determine Which Medications Are Efficacious". Genetic Engineering & Biotechnology News. 13 נוב' 2008.
{{cite web}}: (עזרה) - ↑ עלון התרופה סטיוורגה במשרד הבריאות
- ↑ Regorafenib in patients with metastatic GI Stromal Tumor
- ↑ FDA approves Stivarga for advanced gastrointestinal stromal tumors
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] גיסט27539386


