טומוגרפיה ממוחשבת
טומוגרפיה ממוחשבת (באנגלית: Computed Tomography, בראשי תיבות: CT) היא סוג דימות שנועד לתת תמונה תלת-ממדית של פנים הגוף. בעת ביצוע הבדיקה, מקור קרינה שנע מסביב לחולה מעביר קרני רנטגן דרך הגוף בזוויות שונות.
גלאים הממוקמים מול מקור הקרינה קולטים את הקרניים לאחר שעברו דרך הגוף ושולחים אותות אלקטרוניים למחשב. זה מעבד את הנתונים ויוצר דימות תלת־ממדי של הגוף או תמונות דו־ממדיות של חתכים ספציפיים. כדי להגדיל את איכות הדימות של רקמות רכות, כלי הדם והאיברים החלולים, ניתן למטופל חומר ניגוד. חומרי ניגוד נפוצים הם בריום שנלקח באמצעות שתייה או יוד שמוזרק למערכת הדם. חומרים אלו מקובלים במיוחד בסריקות באזור הבטן.
הטומוגרפיה הממוחשבת הומצאה בשנת 1972 על ידי גודפרי נ. האונספילד במעבדות EMI בבריטניה. בשנת 1979 הוא קיבל את פרס נובל לפיזיולוגיה או לרפואה על המצאה זו, יחד עם אלן מקלאוד קורמאק שחקר במקביל נושאים קשורים. מכשירי הטומוגרפיה הראשונים נזקקו למספר שעות כדי לבצע את הסריקה ולאסוף את הנתונים הגולמיים ולמספר ימים כדי לנתח את הנתונים. סורקים מודרניים מסוגלים לסרוק תוך שניות ספורות, ולהפיק מודל תלת־ממדי באופן כמעט מיידי.
אטימולוגיה
מקור המילה "טומוגרפיה" מקורו במילה היוונית τόμος (טוֹמוֹס) שמשמעה פרוסה או כֶּרֶךְ, ומהמילה γραφ (גרף) שמשמעה ציור או תרשים.[1]
עקרונות הפעולה של סורק CT
סורק CT מורכב ממסגרת קבועה שבתוכה מסתובבת מסגרת מעגלית ובה פתח עגול שדרכו עוברת מיטה שעליה שוכב המטופל. במסגרת המעגלית הסובבת מותקן מקור רנטגן ובדיוק מולו מותקנת סוללת גלאים. במהלך סריקת CT, המטופל שוכב על מיטה ומקור הרנטגן מסתובב סביבו ושולח אלומות צרות של קרני רנטגן שחלקן עוברות דרך גוף המטופל וחלקן נבלעות בו. סוללת הגלאים מלקטת את הקרינה שעברה דרך הגוף. המידע שנקלט בגלאים מועבר למסגרת הקבועה וממנה משודר למחשב השִׁחְזוּר.
בכל פעם שמקור הרנטגן משלים סיבוב, מחשב השחזור מבצע סדרת פעולות מתמטיות שמייצרות תמונה של פרוסת תמונה דו-ממדית דקה של המטופל. המחשב שמייצר את התוצאות הסופיות מאגד מספר פרוסות לכרך – פרוסה שעובייה לרוב 1 עד 10 מילימטרים בהתאם לפרוטוקול הסריקה והשחזור. כל פרוסה מוצגת כתמונה אקסיאלית דו-ממדית אחת.[2]
טכניקות סריקה
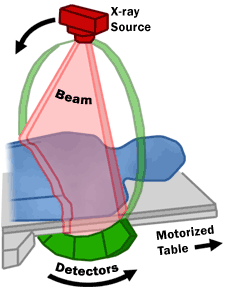
קיימות שתי טכניקות סריקה לאיסוף פרוסות – אַקְסִיאַלִית (צירית) והֶלִיקָלִית (סְלִילָנִית).[1]
בסריקה אקסיאלית המיטה מוצבת כך שקצה האיבר שנסרק נמצא בין המקור והגלאים. המערכת מבצעת סיבוב עם הקרנה סביב המיטה, ההקרנה מופסקת והמיטה זזה לנקודת הסריקה הבאה עד שמושלם כיסוי האיבר שנסרק.
בסריקה הליקלית – המיטה נעה במהירות קצובה לאורך אזור הסריקה בעוד המערכת מסתובבת סביב המיטה. תנועת הסיבוב והתקדמות המיטה מסונכרנות כך שהמקור נע סביב המטופל בתנועת הֶלִיקְס - סליל. מחשב השחזור מעבד את המידע ומייצר ממנו סדרת תמונות של פרוסות אקסיאליות דו-ממדיות.
בשתי הטכניקות מתקבלות סדרות של תמונות פרוסות אקסיאליות דו-ממדיות, אך הטכניקה ההליקלית מהירה יותר ופחות מציקה למטופל. בימינו מעדיפים לרוב סריקות הליקליות. הסריקות האקסיאליות משמשות בעיקר לסריקת איברים קצרים שניתן לכסות בסיבוב אחד של המערכת.
תוצאות הסריקה
תוצאות הסריקה ניתנות להצגה כפרוסות שמאגדות תמונות אקסיאליות או חתכים שלהן בזוויות שונות כתמונה תלת־ממדית, וכן במספר רב של תצוגות שמתוכננות לאיבחונים מסוימים לפי דרישה. היכולת לסובב את תמונה תלת-ממדית בחלל או לצפות בפרוסות ברצף, מקלה על מציאת המקום המדויק בו עשוי להתגלות הממצא.[2]
טומוגרפיה ממוחשבת ככלי אבחוני

מאז שנות ה-70, עת החל השימוש בטומוגרפיה ממוחשבת, היא הפכה לכלי חשוב בתחום דימות רפואי לצד הכלים הקיימים כגון: צילום רנטגן רפואי ובדיקת אולטרה סאונד רפואית. בתחילת המאה ה-21 החל מתרחב השימוש בטומוגרפיה ממוחשבת אף ככלי בתחום רפואה מונעת ובדיקות תקופתיות לגילוי מחלות, לדוגמה, בדיקת קולונוגרפיה למטופלים שלהם סיכון גבוה לחלות בסרטן המעי הגס, או בדיקת דימות של הלב למטופלים בעלי סיכון גבוה לחלות במחלת לב. קיימים מוסדות רפואיים המציעים אף בדיקת טומוגרפיה ממוחשבת של כל הגוף לאוכלוסייה הכללית, אף שארגונים רפואיים רבים מתנגדים לבדיקה זו ללא צורך רפואי מוכח.[3]
ראש
 ערך מורחב – טומוגרפיה ממוחשבת של הראש (סי-טי)
ערך מורחב – טומוגרפיה ממוחשבת של הראש (סי-טי)
השימוש הנפוץ בסריקת טומוגרפיה ממוחשבת של הראש הוא ככלי לאיבחון שבץ מוחי, גידולים מוחיים, הצטברות סידן תוך-גולגולתי, דימום מוחי ושברים בגולגולת. במצבים אלה מבנים כהים בצילומי הדימות עשויים להעיד על בצקת ושבץ, ומבנים בהירים עשויים להעיד על הצטברות סידן, דימומים ונזקים לגולגולת. זיהוי גידולים מוחיים מתאפשר בדימות באמצעות זיהוי עיוותים באנטומיה הנכונה של המוח, הנוצרים כתוצאה מנפיחות.
ריאות
ניתן להשתמש בטומוגרפיה ממוחשבת ככלי לאבחון שינויים כרוניים ותהליכי מחלה ברקמת הריאות. לטומוגרפיה הממוחשבת קיים יתרון על פני צילום רנטגן באבחון מחלות ריאה, כגון מחלת ריאות חסימתית כרונית, פיברוזיס ומחלות דומות. בבדיקות אלה יוצרים חתכי דימות דקים של הריאות, לעיתים הבדיקה נערכת פעמיים, בעת שאיפה ובעת נשיפה. טומוגרפיה ממוחשבת אף יעילה באבחון תסחיף ריאתי כאשר היא משולבת בהחדרת חומר ניגודי לגוף המאפשר את דימות עורקי הריאה.
חלל הבטן והאגן
טומוגרפיה ממוחשבת היא כלי אבחוני רגיש לגילוי מחלות בחלל הבטן. לעיתים נעשה שימוש בכלי זה כדי לקבוע דירוג גידול סרטני. בטומוגרפיה ממוחשבת נעשה שימוש לבירור כאבי בטן חדים (בעיקר בשני הרבעים התחתונים של הבטן, בעוד שבדיקת אולטרה סאונד רפואית היא הכלי הראשון לבירור כאב ברבע הימני העליון של הבטן). אבנים בכליות, דלקת התוספתן, דלקת לבלב, דיברטיקוליטיס, מפרצת באבי העורקים וחסימת מעיים ניתנים כולם לאיבחון ולהערכה בבדיקת טומוגרפיה ממוחשבת. טומוגרפיה ממוחשבת היא אף הכלי העדיף לאיבחון פגיעות באיברים גרמיים באזור האגן לאחר פגיעה טראומטית.
גפיים
טומוגרפיה ממוחשבת היא כלי אבחוני לזיהוי ולהערכת שברים מורכבים בגפיים, בעיקר באזור המפרקים, כיוון שהיא מאפשרת דימות תלת-ממדי של האזור הפגוע במישורים שונים. שברים ופגיעות בגידים ניתנים לדימות ברור בטומוגרפיה ממוחשבת.
יתרונות
לטומוגרפיה ממוחשבת מספר יתרונות בתחום הדימות הרפואי על פני מכשירים המפיקים תמונות דו-ממדיות. ראשית, בתמונת טומוגרפיה ממוחשבת אין חפיפה של מבני הגוף זה על גבי זה בתמונה וניתן להתמקד באיבר המטרה. שנית, מכשירי טומוגרפיה ממוחשבת מפיקים תמונות בהפרדה גבוהה המאפשרת להבחין בהבדלים דקים, אף פחות מ-1%, בין רמת הצפיפות של איברים שונים. לבסוף, דימות בודד בשיטה זו ניתן לבחון בחתכים שונים.
שימוש בטומוגרפיה ממוחשבת חוסכת לעיתים את הצורך בהליכים פולשניים הדרושים לביצוע בדיקות דימות אחרות. כך לדוגמה, בדיקת קולונוגרפיה בטומוגרפיה ממוחשבת (הידועה בכינוי "קולונוסקופיה וירטואלית") בסריקה ברמת קרינה נמוכה עשויה להיות יעילה באותה מידה לאבחון מחלות המעי הגס כמו בדיקת בריום, תוך חשיפת המטופל למידה קטנה יותר של קרינה.[4]
סיכונים
סורקי טומוגרפיה ממוחשבת קורנים בעוצמה גבוהה משמעותית ממצלמות קרני רנטגן רגילות, ומהווים גורם סיכון לסרטן,[5] קָטָרַקְט, זרימת דם לקויה, ועוד בעיות הנובעות מהפגיעה של קרניים אלו ב-DNA.
שיבושים ב-DNA
רמות הקרינה הגבוהות בטומוגרפיה ממוחשבת גורמות לשיבושים ב-DNA של כל תא ותא באבר שמוקרן. השיבושים כוללים שבירה מלאה של גדילי ה-DNA (ראו double strand breaks, שבר דו גדילי), וכך בכל תא נוצרים בממוצע 35 שברים מלאים לגריי קרינה.[6] השיבושים כוללים שיבושים במולקולות האפיגנטיות שצמודות ל-DNA, אשר חלקן מוסרות מה-DNA עקב הקרינה, ובכך משתנה רמת הביטוי של הגנים שהסמן האפיגנטי שלהם הוסר. את השברים ב-DNA התאים מנסים לתקן, אולם התהליך רווי בטעויות הגורמות למוטציות בגנים, הגורמות ליצירת חלבונים מוטנטים. במקרים שבהם התא לא יצליח לתקן את הנזקים, עשוי להיווצר תהליך של אפופטוזה, מוות תאי מתוכנן של התא, למניעת מצבים שבהם עודף נזקים ב-DNA מוביל לסרטן. במקרה ולא נוצר תהליך של אפופטוזה, התא יפעל באופן משובש, דבר שעלול להתבטא בסרטן, או בפעילויות לא תקינות אחרות בעלות השלכות בריאותיות שליליות אחרות. לתאים המתחלקים, כגון תאי גזע, יש סיכוי גבוה יותר למות כתוצאה מהנזק, או להפוך לסרטניים. את השינויים האפיגנטיים התא לא מתקן, וכך נוצר שינוי באופן פעולתו של התא.
הערכת הסיכון להתפתחות סרטן
ככלי להערכת רמת הסיכון להתפתחות סרטן, הומצאה יחידת הסיוורט, שבהתאם לידוע מהסטטיסטיקה, מתאימה לסריקה מסוימת רמת קרינת "משוקללת", שאילו נחשף כל הגוף לרמת קרינה "משוקללת" זו, הסיכון להתפתחות סרטן היה זהה לסיכון להתפתחות סרטן מהסריקה המסוימת בטומגרפיה הממוחשבת. רמת הקרינה ה"משוקללת" המדווחת בסיוורט לרוב נמוכה משמעותית, מרמת הקרינה האמיתית, המדווחת בגריי. הסבר טוב, אבל לא מדויק בכל הפרטים, הוא למשל שהקרנת רגל ב-20 קרניים יש אותו סיכוי לגרימת סרטן כמו הקרנת השוק בלבד ב-20 קרניים, אבל אם נקרין רק את השוק ב-20 קרניים, אז צפיפות הקרניים בשוק תהיה גדולה יותר מאשר הצפיפות כאשר כל הרגל מוקרנת ב-20 קרניים, וצפיפות הקרניים בהקרנת הרגל גדולה מהצפיפות שהייתה אילו כל הגוף היה מוקרן ב-20 קרניים.
הקרינה המשוקללת קטנה מהקרינה האמיתית הנספגת באיבר, כמו שצפיפות הקרניים כשכל הגוף מוקרן קטנה מצפיפות הקרניים כשרק השוק מוקרן באותה כמות קרניים. למרות זאת מבחינת האנרגיה של הקרינה, זו אותה אנרגיה, בין אם היא מופקדת בכל הגוף, או באיבר אחד בלבד. כאשר האנרגיה מופקדת באיבר אחד בלבד, אזי הנזק הנגרם מצטבר באיבר המוקרן בלבד, וגורם לו נזק גדול מאשר אילו היה מוקרן באמת במנת הקרינה המשוקללת. גם הסיכוי לפתח סרטן באותו איבר עולה, אולם מאחר שיתר הגוף לא הוקרן, אז הסיכוי להתפתחות סרטן בשאר הגוף לא עולה, לעומת זאת הקרנת כל הגוף במנת הקרינה המשוקללת, מעלה את הסיכוי לסרטן באיבר אבל בפחות, אבל גם מעלה את הסיכוי להתפתחות סרטן ביתר הגוף, כך שסך הכל הסיכוי לסרטן בשני המקרים זהה, עד כמה שידוע, מהנתונים המועטים מהם ניתן להסיק מסקנות לגבי התפתחות סרטן מקרינת רנטגן.
לדוגמה, סריקת ראש מלווה ברמת קרינה "משוקללת" של 1.5 מיליסיוורט, המחושב על ידי הכפלת רמת הקרינה האמיתית, שהיא 56 מיליגריי, בגורם שקלול המתאים לגודלו של הראש, ולרגישותו לסרטן יחסית לשאר הגוף.[7] אותה רמת קרינה (56 מיליגריי) מלווה בכ 2 שברים דו גדיליים לתא, נתון שלא ניתן להסיק מרמת הקרינה ה"משוקללת". כמו כן האנרגיה הנספגת על ידי הראש בשל רמת קרינה זו (56 מיליגריי) שקולה לאנרגיה שהראש היה סופג מקרינת הרקע רק כעבור כ 23 שנים, בעוד ולפי רמת הקרינה המשוקללת המדווחת ניתן לטעות ולחשוב שהראש סופג אנרגיה כזו מקרינת הרקע תוך חצי שנה. בדיקות CT רבות כוללות שתי סריקות, אחת עם חומר ניגוד, ושנייה ללא חומר ניגוד, דבר המכפיל את כמות הקרינה, ואת הנזק ל-DNA. יכולתו של התא לתקן שברים ב-DNA שונה מאדם לאדם. אנשים שיכולת התיקון אצלם פחותה יסבלו מיותר תופעות לוואי עקב חשיפה לקרינה.
תופעות לוואי של שימוש בחומרי ניגוד
כאשר הסריקה מלווה בספיגה של חומר ניגוד, חומר הניגוד יכול ליצור תופעות לוואי שכוללת תגובות פסודו אלרגיות ב 12% מהאנשים, ותופעות לוואי קשות ב 0.2% מהאנשים, ובין עשרה לשלושים אנשים ממיליון צפויים למות מיידית כתוצאה מתופעות הלוואי הקשות הללו.[8] כאשר מוזרק חומר הניגוד, בדרך כלל מוזרקים כ-40 מ"ל כאשר שליש מהחומר הוא יוד, כלומר כ-13 גרם של יוד. הכמות המרבית לצריכה יומית של יוד היא 0.001 גרם. לכן עלולות להתרחש תופעות לוואי של צריכה עודפת של יוד, ובכללן נזק לכליות המפנות את היוד מהגוף ב 7% מהמקרים, שיכול להוביל לצורך קבוע בדיאליזה.[9]
סיכוני קרינה מצטברת
מטיוטה של הוועדה הבינלאומית להגנה מקרינה עולה כי כמות מצטברת של 500 מיליגריי של קרינה יכולים לגרום לקָטָרַקְט, ולהסתיידות עורקים. כמות קרינה זו יכולה להצטבר בעקבות מספר קטן של סריקות CT, לפעמים גם עקב סריקה אחת. עוד עולה מהטיוטה כי חשיפת תינוקות לקרינה של 100 מיליגריי גורמת לליקויים קוגניטיביים.[10]
כמויות קרינה
כמות הקרינה הנספגת בבן אדם בסריקת CT משתנה ממכשיר למכשיר, ומאדם לאדם. הערכים המובאים להלן הם ערכים ממוצעים, שנמצאו בבדיקת מכשירים מסוימים, כאשר הערכים המרביים שנמצאו בדרך כלל היו פי שניים מהממוצע המדווח. לעיתים מבוצעות שתי סריקות או יותר בבת אחת, למשל בלי יוד ועם הזרקת יוד, מה שיכול להעלות את כמות הקרינה שוב פי שניים (כלומר סך הקרינה יכול להיות פי 4 מהממוצע המדווח כאן). כמו כן ישנם פרוטוקולי סריקה שונים אפילו לאותו איבר, מה שיכול לשנות את רמות הקרינה, וכן טעויות אנוש, או מכונה יכולים להעלות את רמות הקרינה לרמות שמיועדות להרוג תאים בחולי סרטן 1500 עד 4000 מיליגריי נרשמו עקב טעויות כאלה.[11][12][13][14][15]
| המקרה | מנה אפקטיבית (mSv) לכל הגוף |
מנה נספגת (mGy) באיבר המוקרן |
מספר השנים שהיה לוקח לאיבר לספוג את מנת הקרינה מהטבע |
|---|---|---|---|
| קרינת רקע שנתית | 2.4[15] | 2.4[15] | 1 |
| ראש CT | 1-2[13] | 56[16] | 23 |
| בטן CT | 8[17] | 14[16] | 5.8 |
| חזה CT | 5-7[13] | 13[16] | 5.4 |
| חזה בטן ואגן CT | 9.9[16] | 12[16] | 5 |
| Cardiac CT angiogram | 9-12[13] | 40-100[11] | 41 |
| Neonatal abdominal CT | 20[12] | 20[11] | 8.3 |
| CT colonography | 6-11[13] | ||
| Barium enema | 15[12] | 15[11] | 6.25 |
| Screening mammography | 0.4[18] | 3[12][11] | 1.25 |
| רנטגן חזה | 0.02[17] | 0.01-0.15[11] | 0.0625 |
הסבר על מנות הקרינה
המנה הנספגת היא מנת הקרינה האמיתית הנספגת באיבר המוקרן, והיא פרופורציונלית לכמות האנרגיה הנספגת באיבר המוקרן, ולכמות הנזק המולקולרי הנגרם לכל תא מוקרן. המנה האפקטיבית היא מנת קרינה של תרחיש דמיוני בו כל הגוף מוקרן, והקרינה נספגת באופן אחיד בכל איבר ואיבר בגוף, והעוצמה האחידה הנספגת בתרחיש זה היא כזו שמאמינים שיכולה לגרום לסרטן כמו תרחיש הקרינה הלא אחידה ב-CT המדובר, למשל בדיקת CT של איבר מסוים. עבור אותה סריקת CT, המנה האפקטיבית לרוב קטנה משמעותית מהמנה הנספגת האמיתית, מאחר שבתרחיש המנה האפקטיבית כל הגוף מוקרן באותה המנה, ולכן נוצרים סיכויים להתפתחות סרטן בכל הגוף המתווספים זה לזה, ולכן מנות הקרינה הנמוכות הנספגות בכל הגוף יוצרות סיכויים להתפתחות סרטן באיברים רבים והם מסתכמים לכדי סיכויי התפתחות סרטן גבוהים כמו סיכויי התפתחות הסרטן באיבר המסוים הסופג לבדו את מנת הקרינה הנספגת האמיתית. יצוין שהסיכויים להתפתחות סרטן הם רק הערכות הנובעות מחישובים סטטיסטיים של שורדי ההפצצות האטומיות ביפן במלחמת העולם השנייה, וייתכן ואינן מדויקות עבור CT.
יחידות המנה הפיזיקלית הנספגת לדוגמה הן גריי Gy או מיליגריי mGy (אלפית הגריי). יחידות המנה הביולוגית הנספגת לדוגמה הן סיוורט Sv, או מיליסיוורט mSv (אלפית הסיוורט).
ראו גם
- דימות תהודה מגנטית – MRI
- קרני רנטגן
- קרינה אלקטרומגנטית
- בדיקת אולטרה סאונד רפואית
- בדיקות לא הורסות
- בדיקת PET CT
קישורים חיצוניים
 אלישע בר מאיר, מנפצים את המיתוס: || למה לא צריך לפחד מבדיקת סי-טי, באתר הארץ, 20 בינואר 2014
אלישע בר מאיר, מנפצים את המיתוס: || למה לא צריך לפחד מבדיקת סי-טי, באתר הארץ, 20 בינואר 2014- טומוגרפיה ממוחשבת, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ^ 1.0 1.1 Center for Devices and Radiological Health, What is Computed Tomography?, FDA, 2020-09-28
- ^ 2.0 2.1 Computed Tomography (CT), www.nibib.nih.gov
- ↑ Whole-Body Computerized Tomography Screening Should Not Be Performed
- ↑ Evaluation of patient dose for barium enemas and CT colonography in Japan. British Journal of Radiology 2009;82:219-227
- ↑ דן אבן, מחקר: הסיכון לסרטן מסי-טי גדול מהידוע, באתר הארץ, 16 בדצמבר 2009
- ↑ Evidence for a lack of DNA double-strand break repair in human cells exposed to very low x "The line is a linear fit to the data points with a slope of 35 DSBs per cell per Gy." e.g. 35[DSB/Gy]*56[mGy]=1.96[DSB]
- ↑ Multisection CT Protocols: Sex- and Age-specific Conversion Factors Used to Determine Effective Dose from Dose-Length Product.
- ↑ Agents that induce pseudo-allergic reaction.
- ↑ Hasebroock, KM; Serkova, NJ (באפריל 2009). "Toxicity of MRI and CT contrast agents". Expert opinion on drug metabolism & toxicology. 5 (4): 403–16. PMID 19368492.
{{cite journal}}: (עזרה) - ↑ "www.icrp.org" (PDF).
- ^ 11.0 11.1 11.2 11.3 11.4 11.5 Hall, EJ; Brenner, DJ (במאי 2008). "Cancer risks from diagnostic radiology". The British journal of radiology. 81 (965): 362–78. PMID 18440940.
{{cite journal}}: (עזרה) - ^ 12.0 12.1 12.2 12.3 Brenner DJ, Hall EJ (בנובמבר 2007). "Computed tomography--an increasing source of radiation exposure" (PDF). N. Engl. J. Med. 357 (22): 2277–84. doi:10.1056/NEJMra072149. PMID 18046031.
{{cite journal}}: (עזרה) - ^ 13.0 13.1 13.2 13.3 13.4 Furlow, B (במאי–ביוני 2010). "Radiation dose in computed tomography" (PDF). Radiologic technology. 81 (5): 437–50. PMID 20445138.
{{cite journal}}: (עזרה)(הקישור אינו פעיל) - ↑ Wintermark M, Lev MH (בינואר 2010). "FDA investigates the safety of brain perfusion CT". AJNR Am J Neuroradiol. 31 (1): 2–3. doi:10.3174/ajnr.A1967. PMID 19892810.
{{cite journal}}: (עזרה) - ^ 15.0 15.1 15.2 Cuttler JM, Pollycove M (2009). "Nuclear energy and health: and the benefits of low-dose radiation hormesis". Dose Response. 7 (1): 52–89. doi:10.2203/dose-response.08-024.Cuttler. PMC 2664640. PMID 19343116.
- ^ 16.0 16.1 16.2 16.3 16.4 Shrimpton, P.C; Miller, H.C; Lewis, M.A; Dunn, M. Doses from Computed Tomography (CT) examinations in the UK - 2003 Review
- ^ 17.0 17.1 "What are the Radiation Risks from CT?". Food and Drug Administration. 2009.
- ↑ Davies, H. E.; Wathen, C. G.; Gleeson, F. V. (25 בפברואר 2011). "The risks of radiation exposure related to diagnostic imaging and how to minimise them". BMJ. 342 (feb25 1): d947–d947. doi:10.1136/bmj.d947.
{{cite journal}}: (עזרה)
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
טומוגרפיה ממוחשבת40759992Q32566


