גליובלסטומה מולטיפורמה
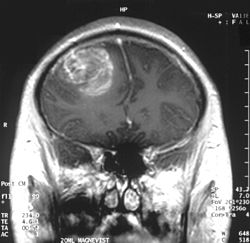 | |
| MRI המדגים גליובלסטומה בזכר בן 15. | |
| תחום | אונקולוגיה |
|---|---|
| קישורים ומאגרי מידע | |
| DiseasesDB | 29448 |
| MeSH | D005909 |
| OMIM | 137800 |
| סיווגים | |
| ICD-10 | C71 |
| ICD-O | M9440/3 |


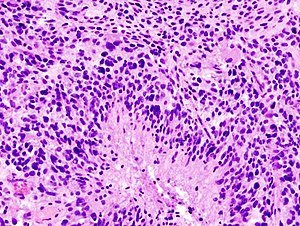

גליובלסטומה (באנגלית: Glioblastoma multiforme, ידוע גם בקיצור GBM, נקרא גם אסטרוציטומה שלב IV) היא סרטן המוח הנפוץ והאגרסיבי ביותר. גליובלסטומה מהווה 15.4% מכלל גידולי המוח הראשוניים בכלל ו-45.6% מכלל גידולי המוח הממאירים הראשוניים. ברוב המקרים הגורם אינו ידוע. הפרוגנוזה של גידול זה עגומה: עם טיפול, תוחלת החיים הממוצעת מרגע האבחנה היא בערך 12–15 חודשים, כשפחות מ-3%-5% שורדים יותר מחמש שנים. כ-3 אנשים מתוך 100,000 מתגלים כל שנה כחולים במחלה.[1] הגיל החציוני של החולים במחלה הוא 64 אך היא יכולה להופיע בכל גיל, כולל אצל ילדים. לגברים סיכויים מעט גבוהים יותר לחלות בגליובלסטומה מאשר נשים (1.6:1) וכך גם לתושבי העולם המערבי לעומת שאר העולם.[2] חלק מהסיבות להיות GBM הקטלנית ביותר מבין כל הגליומות הן קצב ההתרבות התאית המואץ שלו, יכולת הפלישה, אנגיוגנזה (התהוות ויצירת כלי דם), התנגדות לאפופטוזיס (מנגנון השמדה עצמית של תאים) ושינויים רבים בגנום התאים.[3]
הסימנים והסימפטומים תחילה אינם ספציפיים. הם עלולים לכלול כאבי ראש, לקויים עצביים, איבוד זיכרון ושינויי אישיות. לעיתים ההחמרה בסימפטומים היא מהירה, והם יכולים להתקדם עד לחוסר הכרה. רוב הסימפטומים הללו נגרמים בשל לחץ תוך גולגולתי, אשר שנובע מההתפשטות המהירה של הגידול.[4]
במקרים נדירים יכול להופיע סוג סרטן זה גם בחוט השדרה.
סימנים וסימפטומים
הסימנים והסימפטומים של המחלה רבים ושונים, ותלויים במיקום הגידול. הם יכולים לנבוע הן מהגידול עצמו והן מהטיפולים שכן אלו וגם אלו משפיעים ישירות על המוח עצמו. התסמינים יהיו נוירולוגים, קוגניטיביים ולעיתים אף פסיכיאטרים. ביניהם פירכוסים, בחילות והקאות, כאבי ראש, אובדן זיכרון והמיפרזיס (חולשה בחלק אחד של הגוף). סימפטומים פסיכיאטרים עלולים לכלול פסיכוזות, הלוצינציות, שינויי מצב רוח ושינויי אישיות, שיידרשו, כתלות בחומרתם, טיפול פסיכיאטרי או תרופתי. כיוון שחלקים שונים של המוח אחראים על תפקודים שונים, הסימפטומים יהיו במקרים רבים תלויי גידול. למשל, חולים עם גידול באונה הקדמית דיווחו יותר על חוסר עכבות וקשיי שיפוט מחולים אחרים.[5]
התסמינים יכולים להופיע מיד, אך לעיתים הגידול יגיע לממדים גדולים מאד טרם יופיע תסמינים כלשהם. תסמינים השכיחים ביותר בחודש האחרון לחיים היו הפרעות בליעה (85%), ישנוניות (85%), כאבי ראש (36%), פרכוסים (30%) ובלבול/דילריום (15%).[6] קשיי התקשורת ושינויי האישיות המופיעים במטופלים רבים עשויים להוות אתגר משמעותי למטופלים, למטפלים ולבני משפחותיהם.
גורמי סיכון
גליובלסטומה מתרחשת יותר בקרב גברים מעל גיל 50 ממוצא לבן, היספני ואסיאתי.[7] רוב מקרי הגליובלסטומה מופיעים ללא כל נטייה גנטית. לא נמצא קשר בין גליובלסטומה לעישון,[8] צריכת בשר מעובד[9] או חשיפה לשדות אלקטרו-מגנטיים.[10] ייתכן שיש קשר בין הגידול לבין צריכת אלכוהול.[11] ייתכן שיש קשר נמוך בין קרינה מייננת וגליובלסטומה.[12] אנליזה מ-2006 הראתה קשר בין סרטן המוח לחשיפה לעופרת במקום עבודה.[13]
אסטרוציטומה מדרגה נמוכה עלולה, לעיתים קרובות, להתפתח לגידול בדרגה גבוהה יותר. המחלות הגנטיות הבאות קשורות עם שכיחות גבוהה יותר של גליומות: נוירופיברומטוזיס, תסמונת לי פרומני, תסמונת טורקוט, טרשת גבשושית ותסמונת ון-היפל לינדאו.
גליובלסטומה בדרך כלל מכילה שילוב של מגוון סוגי תאים, שנמשכים ומצטרפים לגידול בשל העובדה שהוא נתמך בידי כלי דם רבים בנוסף הגידול שולח שלוחות לתוך רקמת המוח הבריאה. לכן, יכולה המחלה להיות קשה לטיפול. חלק מן התאים מגיבים בצורה טובה לטיפולים מסוימים, אך תאים אחרים יכולים להיות לא מושפעים מהם כלל. זוהי הסיבה שטיפול במחלה חייב לשלב מספר גישות שונות.[14]
אפידמיולוגיה
שכיחות סרטן זה עולה עם הגיל, כשהשיא הוא בין הגילאים 75–84.
אבחון
האבחון נעשה בדרך כלל על ידי בדיקת MRI, בדיקת CT, כשהאבחנה הסופית נעשית על ידי ביופסיה. כיוון שדרגת הגידול נקבעת על פי החלקים הממאירים ביותר שלו, עלולה הביופסיה להטעות ולקבוע את רמת הגידול כנמוכה יותר.
חשוב להבחין בין גליובלסטומה ראשונית לגליובלסטומה משנית - גידולים המתפתחים באופן ספונטני או גידולים המתפתחים מגליומות בדרגה נמוכה, בהתאמה. לגליובלסטומה ראשונית יש את הפרוגנוזה הגרועה ביותר, וההבחנה ביניהם חשובה לקביעת סוג הטיפול. מעל 80% מגליובלסטומות משניות נושאות מוטציה בגן IDH1, מוטציה שנדירה בגליובלסטומות ראשוניות (5%-10%). כך שמוטציה זו מהווה כלי שימושי לאבחון סוג הגידול משום שמבחינה היסטולוגית הגידולים דומים מאד, ואבחנה ללא סמנים ביולוגים מולקולריים לא אמינה.
טיפול
הטיפול בגידול קשה בשל כמה סיבות: תאי הגידול עמידים מאד בפני הטיפולים הקונבנציונליים, המוח רגיש מאד לטיפולים, ועלול להינזק מהם, המוח מוגבל מאד ביכולת שלו לטפל בעצמו, תרופות רבות אינן מסוגלות לחצות את מחסום דם-מוח. טיפולים בגידול הראשוני ובגרורות מוחיות כוללים הן טיפול בסימפטומים והן טיפול פליאטיבי.
טיפול סימפטומטי
טיפול זה מתמקד בהקלה על התסמינים ושיפור איכות חייו של המטופל על ידי תרופות אנטי-אפלפטיות וכקורטיקוסטרואידים.
- היסטורית, כ-90% מהמטופלים עם גליובלסטומה קיבלו טיפול אנטי-אפילפטי, אף על פי שההערכה היא שרק 40% מהמטופלים נדרשו באמת לטיפול זה. קבלת פניטואין יחד עם הקרנות עלולה להוביל לתגובות קשות בעור כמו אריתמה מולטיפורמה ותסמונת סטיבן-ג'ונסון.
- הטיפול הסטרואידי יהיה בדרך כלל של דקסמטזון, במטרה להפחית בצקת ובכך להפחתת לחץ תוך-גולגולתי, מה שיכול להפחית סימפטומים של כאבי ראש ונמנום.
טיפול פליאטיבי
מטרת הטיפול הפליאטיבי הוא שיפור איכות החיים והארכתם. טיפול זה יכול לכלול ניתוח (עם שוליים נקיים ככל הניתן), הקרנות וכימותרפיה. כריתה מלאה של הגידול מזוהה עם פרוגנוזה טובה יותר.
ניתוח
הניתוח הוא השלב הראשון של הטיפול בגליובלסטומה. מטרות הניתוח הן כריתה עבור אבחנה פתולוגית, הקלה של התסמינים וכן הסרת המחלה טרם פיתוח עמידות להקרנות וכימותרפיה.
ככל שהיקף הגידול המוסר גדול יותר, כך הפרוגנוזה טובה יותר. הסרה של 98% או יותר מהגידול קשורה באופן משמעותי עם איכות חיים טובים יותר. הסיכויים של הסרה כמעט מוחלטת של הגידול גדלים אם הניתוח מונחה על ידי צבע פלואורסצנטי בשם חומצה אמינולבולינית-5. תאי הגידול בעת האבחנה מפוזרים באופן נרחב במוח, כך שגם במקרים של כריתה מוחלטת של הגידול הוא בדרך כלל יחזור ויופיע ליד האתר המקורי או במקומות רחוקים יותר במוח. המטופל יקבל הקרנות וכימותרפיה במאמץ לדכא ולהאט חזרה של המחלה. עם ניתוח בלבד, שיעור ההישרדות החציוני עומד על שישה חודשים.
הקרנות
טיפול רדיותרפי לאחר ניתוח הפך לטיפול הסטנדרטי בגליובלסטומה מאז שנות השבעים. טיפול זה ניתן בדרך כלל עם טמוזולומיד (טמודל). בממוצע, מוריד הטיפול הרדיותרפי את גודל הגידול ל-107 תאים. הטיפול המקובל הוא טיפול במינון של עד 60 Gy.
אף כי התאים הסרטניים רגישים יותר לקרינה, גם תאי המוח הרגילים עלולים להינזק במהלך טיפול. נזק כזה, אם קורה, יהיה בדרך כלל קל, וישפיע על החדות הקוגניטיבית והיכולת לחשוב ולבצע משימות מורכבות. תופעות לוואי מהסוג הזה עלולות להחמיר ככל ששדה הקרינה גדול יותר וממושך יותר ונוטה להחמיר עם הזמן. תופעות לוואי אלו נוגעות יותר לאנשים ששורדים כמה שנים לאחר ההקרנות, מה שאינו קורה בדרך כלל בגליובלסטומה. נוסף לכך, קרינה יכולה להשפיע גם על מאזן ההורמונים בגוף על תופעות הלוואי הכרוכות בשינוי מאזן זה.
כימותרפיה
הטיפול הסטנדרטי בגידול זה הוא טיפול רדיותרפי יחד עם טמוזולומיד, המוכרת בשם המסחרי שלה - טמודל. זוהי תרופה ציטוטוקסית שמשתייכת לתכשירי אלקילציה שנכנסה לשימוש בשנת 2000. ייחודה של תרופה זו בניגוד לתרופות כימותרפיות אחרות היא יכולתה לחדור לרקמת המוח ולגידול. הטיפול נעשה דרך הפה וסבילותו בדרך כלל טובה.
מחקר גדול של 575 משתתפים הראה כי מטופלים שקיבלו טיפול רדיותרפי יחד עם טמודל שרדו 14.6 חודשים, לעומת 12.1 חודשים במטופלים שקיבלו הקרנות בלבד. בקרב אותם מטופלים, שיעורי ההישרדות לאחר 24 חודשים היו 26.5% בטיפול המשולב לעומת 10.4% בטיפול הקרינתי בלבד. מחקר המשכי שנערך לאחר 5 שנים הראה שיתרון ההישרדות שהודגם לאחר שנתיים המשיך גם לאחר מכן: לאחר ארבע שנים שרדו 12.1% מהחולים שטופלו בטיפול המשולב לעומת 3% שקיבלו טיפול קרינתי בלבד.[15] בעבודה שניתחה באמצעות מטא-אנליזה את תוצאותיהם של 12 מחקרים שגייסו יותר מ-3,000 חולים לצורך השוואה פרוספקטיבית אקראית של זרועות הטיפול, הוכח שטיפול כימי שיפר את ההישרדות ב-6% בתום שנה מהאבחנה, נתון שהיה בעל משמעות סטטיסטית מובהקת.[16] הטיפול הכימי הביא להארכת חציון ההישרדות בחודשיים ימים כיום הטיפול הסטנדרטי בסוג סרטן זה הוא הקרנות יחד עם טמודל. נראה כי הטמודל מגביר את הרגישות של תאי הגידול לקרינה. מנות גבוהות של טמודל אינן מעלות משמעותית את הרעילות שלו, אך היעילות של מינונים גבוהים יותר אינה גבוהה יותר ממינון סטנדרטי.
טיפול אנטי-אנגיוגני
כמו בגידולים רבים אחרים, גם במקרה של גליובלסטומה מתמקד המחקר בתרופות ביולוגיות "חכמות". את התוצאות המבטיחות ביותר עבור סוג זה של סרטן השיגה בבקיזומב אווסטין, המוכרת יותר בשמה אווסטין. זוהי תרופה אנטי סרטנית הפוגעת ביכולתו של הגידול הסרטני ליצור כלי דם - אנגיוגנזה. במחקר שנערך על 167 חולים הודגמה תוצאה של 42.6% PFS-6 (שישה חודשים ללא התקדמות המחלה), זאת בהשוואה ל-9% המקובל בטיפולי קו שני ושלישי בגידול. מחקרים שנעשו על טיפול באווסטין בגליובלסטומה ראשונית הראו הארכה משמעותית ב-PFS, אך לא נמצא שינוי משמעותי בהישרדות כוללת (Overall Survival). הסבר אפשרי לשוני בין הנתונים הללו הוא שהגידול מפתח עמידות לתרופה או שכלי הדם גדלים במהירות לאחר סיום הטיפול. בנוסף, חלה במטופלים ירידה נוירו-קוגניטיבית, הוחמרו תסמינים נוירולוגיים ונצפתה ירידה באיכות החיים לאורך זמן. עם זאת, המחקר על התרופה זו עוד לא הגיע לידי מיצויו, ונכון ל-2016, מחקרים רבים עודם בעיצומם.[17][18]
TTFields (שדות לטיפול בגידולים)
זהו טיפול המבוסס על השריית שדות חשמליים בעצמה ותדירות נמוכה אל המוח. בשיטה זו מוצמדים לקרקפת מתמרים באופן לא פולשני (ההצמדה דורשת גילוח של שיער הראש). פעילות השדות החשמליים משיגה אפקט אנטי-מיטוטי (כלומר, משבשת את פעילות המיטוזה) על תאים שחלוקתם מהירה, אך אינה פוגעת בתאים שאינם מתחלקים. הטיפול בטכנולוגיה זו בחולי גליובלסטומה מולטיפורמה קיבלה אישור של מנהל התרופות האמריקני בשנת 2011.
על פי מחקר קליני משנת 2017 שהוצג בכנס השנתי של האיגוד העולמי לנוירוכירורגיה אונקולוגית (WFNS) שכלל 695 חולים ב-GBM, שיעור ההישרדות החציוני של החולים שטופלו ב-TTFields במקביל לטיפול הסטנדרטי היה 21 חודשים, לעומת 16 חודשים בחולים שטופלו בטיפול הסטנדרטי בלבד. כמו כן, נמצא כי 1 מתוך 7 מטופלים יחיה כ-5 שנים. 43% מהחולים שטופלו בטכנולוגיה היו בחיים לאחר שנתיים בהשוואה ל-31% שלא טופלו בה ו-26% לעומת 16%, 20% לעומת 8%, ו-13% לעומת 5% כעבור שלוש, ארבע וחמש שנים, בהתאמה. הסבילות לטיפול הייתה טובה ותופעת הלוואי היחידה שנצפתה הייתה גירוי מקומי בעור בשיעור של 43% מהמטופלים ברמה קלה עד בינונית.[19][20]
פרוגנוזה
תוחלת החיים החציונית ללא טיפול היא שלושה חודשים ועם טיפול כ-12–15 חודשים. ככל שהגיל עולה הפרוגנוזה גרועה יותר. גיל מתחת ל-50 קשור לתוחלת חיים ארוכה יותר. טיפול כירורגי (בייחוד במקרה של הסרת למעלה מ-98% מהגידול), רדיותרפי וכימותרפי קשורים להארכת תוחלת החיים. עם זאת, לא ברור מדוע מטופלים מסוימים שורדים זמן ממושך יותר מאחרים. גורם המוות בדרך כלל היא התפשטות הגידול עם בצקת באזור הצרבלום והגדלת הלחץ התוך-גולגולתי.
מקורות
- Hart, MG; Garside, R; Rogers, G; Stein, K; Grant, R (30 באפריל 2013). "Temozolomide for high grade glioma". The Cochrane database of systematic reviews. 4: CD007415. doi:10.1002/14651858.CD007415.pub2. PMID 23633341.
{{cite journal}}: (עזרה)
קישורים חיצוניים
- גליובלסטומה - הווה ועתיד, פרופ' טלי סיגל, גב‘ עדנה שלום, באתר Medical Media.
- גידולי מוח באתר האגודה למלחמה בסרטן.
הערות שוליים
- ↑ Farina Hanif, Glioblastoma Multiforme: A Review of its Epidemiology and Pathogenesis through Clinical Presentation and Treatment, Pubmed
- ↑ Mary Elizabeth Davis, Glioblastoma: Overview of Disease and Treatment, Pubmed
- ↑ Dan Peer, Harnessing nanomedicine for therapeutic intervention in glioblastoma, Taylor & Francis
- ↑ Glioblastoma (GBM), American Brain Tumor Association
- ↑ Florien W Boele, Alasdair G Rooney, Robin Grant, and Martin Klein1, Psychiatric symptoms in glioma patients: from diagnosis to management, Neuropsychiatr Dis Treat, 2015 doi: 10.2147/NDT.S65874
- ↑ Esther Lin, Mark A. Rosenthal, Brian H. Le, and Peter Eastman, Neuro-oncology and palliative care: a challenging interface, Neuro Oncol, עמ' 2012 Sep; 14
- ↑ Ohgaki, Hiroko; Kleihues, Paul (2005). "Population-Based Studies on Incidence, Survival Rates, and Genetic Alterations in Astrocytic and Oligodendroglial Gliomas". Journal of Neuropathology & Experimental Neurology. 64 (6): 479–89. PMID 15977639.
- ↑ Zheng, Tongzhang; Cantor, Kenneth P.; Zhang, Yawei; Chiu, Brian C. H.; Lynch, Charles F. (2001). "Risk of Brain Glioma not Associated with Cigarette Smoking or Use of Other Tobacco Products in Iowa". Cancer Epidemiology, Biomarkers & Prevention. 10 (4): 413–4. PMID 11319186.
- ↑ Wheeler, Lamar; Huncharek, Michael; Kupelnick, Bruce (2003). "Dietary Cured Meat and the Risk of Adult Glioma: A Meta-Analysis of Nine Observational Studies". Journal of Environmental Pathology, Toxicology and Oncology. 22 (2): 129–37. doi:10.1615/JEnvPathToxOncol.v22.i2.60. PMID 14533876.
- ↑ Savitz, David A.; Checkoway, Harvey; Loomis, Dana P. (1998). "Magnetic Field Exposure and Neurodegenerative Disease Mortality among Electric Utility Workers". Epidemiology. 9 (4): 398–404. doi:10.1097/00001648-199807000-00009. PMID 9647903.
- ↑ Baglietto, Laura; Giles, Graham G.; English, Dallas R.; Karahalios, Amalia; Hopper, John L.; Severi, Gianluca (2011). "Alcohol consumption and risk of glioblastoma; evidence from the Melbourne collaborative cohort study". International Journal of Cancer. 128 (8): 1929–1934. doi:10.1002/ijc.25770. PMID 21344375.
- ↑ Cavenee, WK (2000). "High-grade gliomas with chromosome 1p loss". Journal of Neurosurgery. 92 (6): 1080–1. doi:10.3171/jns.2000.92.6.1080. PMID 10839286.
- ↑ Van Wijngaarden, Edwin; Dosemeci, Mustafa (2006). "Brain cancer mortality and potential occupational exposure to lead: Findings from the National Longitudinal Mortality Study, 1979–1989". International Journal of Cancer. 119 (5): 1136–44. doi:10.1002/ijc.21947. PMID 16570286.
- ↑ Glioblastoma (GBM), American Brain Tumor Association
- ↑ Stupp, Roger; Mason, Warren P.; Van Den Bent, Martin J.; Weller, Michael; Fisher, Barbara; Taphoorn, Martin J.B.; Belanger, Karl; Brandes, Alba A.; et al. (2005). "Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma". New England Journal of Medicine. 352 (10): 987–96. doi:10.1056/NEJMoa043330. PMID 15758009.
- ↑ Stewart LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 2002;359:1011-1018
- ↑ Peng Fu, Yun-Song he, Qin Huang, Tao Ding, Yong-cun Cun, Hong-Yang Zhao, and Xiang Wei, Bevacizumab treatment for newly diagnosed glioblastoma: Systematic review and meta-analysis of clinical trials, Mol Clin Oncol מיקום בסדרה doi: 10.3892/mco.2016.816
- ↑ Mark R. Gilbert, M.D., James J. Dignam, Ph.D., Terri S. Armstrong, Ph.D., A.N.P.-B.C., Jeffrey S. Wefel, Ph.D., Deborah T. Blumenthal, M.D., Michael A. Vogelbaum, M.D., Ph.D., Howard Colman, M.D., Ph.D., Arnab Chakravarti, M.D., Stephanie Pugh, Ph.D., Minhee Won, M.A., Robert Jeraj, Ph.D., Paul D. Brown, M.D., Kurt A. Jaeckle, M.D., David Schiff, M.D., Volker W. Stieber, M.D., David G. Brachman, M.D., Maria Werner-Wasik, M.D., Ivo W. Tremont-Lukats, M.D., Erik P. Sulman, M.D., Kenneth D. Aldape, M.D., Walter J. Curran, Jr., M.D., and Minesh P. Mehta, M.D., A Randomized Trial of Bevacizumab for Newly Diagnosed Glioblastoma, The New England Journal Of Medicine, February 20, 2014 doi: 10.1056/NEJMoa1308573
- ↑ Stupp R, Taillibert S, Kanner AA, Kesari S, Steinberg DM, Toms SA, Taylor LP, Lieberman F, Silvani A, Fink KL, Barnett GH, Zhu J, Henson JW, Engelhard HH, Chen TC, Tran DD, Sroubek J, Tran ND, Hottinger AF, Landolfi J, Desai R, Caroli M, Kew Y, Honnorat J, Idbaih A, Kirson ED, Weinberg U, Palti Y, Hegi ME, Ram Z., Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for GlioblastomaA Randomized Clinical Trial., JAMA, 2015
- ↑
 רחל גרוסמן, תקווה לחולים בגידול נפוץ ואגרסיבי במוח, באתר הארץ, 16 בספטמבר 2017
רחל גרוסמן, תקווה לחולים בגידול נפוץ ואגרסיבי במוח, באתר הארץ, 16 בספטמבר 2017
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] גליובלסטומה מולטיפורמה26456613


